Побочный эффект CAR T терапии возникает из-за пироптоза опухолевых клеток
Китайские исследователи показали, что CAR T-лимфоциты убивают опухолевые клетки посредством пироптоза. Именно из-за этого макрофаги синтезируют провоспалительные цитокины, приводящие к развитию синдрома высвобождения цитокинов — побочного эффекта CAR-T-клеточной терапии.
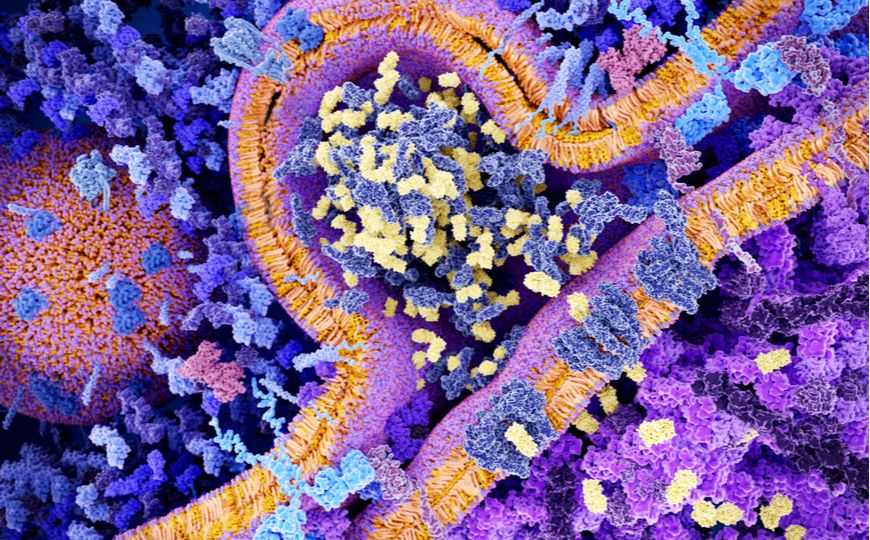
CAR T-терапия. Молекулы CAR (светло-голубой) связываются с молекулами CD19 на клетке лейкоза, что приводит к формированию везикул с гранзимом (желтый), которые активируют клеточную гибель.
Credit: Juan Gaertner | Shutterstock.com
Одним из прогрессивных методов лечения B-клеточных лимфом и лейкозов является терапия генетически модифицированными Т-клетками, несущими химерный антигенный рецептор (CAR-T). Такое лечение имеет побочный эффект — синдром высвобождения цитокинов (cytokine release syndrome, CRS), связанный с увеличением количества провоспалительных цитокинов в крови. Было показано, что макрофаги вовлечены в развитие CRS, однако механизм этого процесса неясен.
Исследователи под руководством Бо Хуана из Китайской академии медицинских наук показали, что CRS возникает из-за гибели опухолевых клеток путем пироптоза. Это вариант программируемой клеточной гибели, при котором белок газдермин Е формирует поры в мембране клетки, она набухает, а содержимое цитоплазмы выбрасывается наружу. Исследователи инкубировали специфические CAR T-клетки (узнающие CD19 маркер B-клеток) с опухолевыми клетками CD19+, полученными от пациентов с острым лимфобластным лейкозом (ОЛЛ), и наблюдали у этих клеток признаки пироптоза. С помощью атомно-силовой микроскопии ученые обнаружили поры в их мембране. Также они показали, что именно газдермин Е нужен для осуществления пироптоза: в случае его нокаута опухолевые клетки погибали апоптозом.
Авторы статьи детально изучили процесс, который приводит к пироптозу. CAR-T при распознавании антигена выделяют перфорин и гранзим B. Первый формирует поры в мембране клетки-мишени, через которые внутрь клетки попадает гранзим B. Он активирует каспазу 3, а она, в свою очередь, активирует газдермин Е. Интересно, что обычные Т-клетки, специфичные к опухолевым клеткам, также выделяют перфорин и гранзим B, но клетки опухоли при этом гибнут посредством апоптоза. Оказалось, что из-за лучшего связывания антигена CAR модифицированные Т-лимфоциты синтезируют больше этих белков, сдвигая тем самым баланс в сторону пироптоза.
Исследователи также подтвердили роль макрофагов в реализации CRS. При обработке супернатантом, полученным после совместного культивирования CAR-T и опухолевых клеток, макрофаги синтезировали провоспалительные цитокины IL-1β и IL-6 — основные маркеры CRS. Значит, молекулы, выделяемые клетками при пироптозе (в данном случае: АТФ и HMGB1), стимулировали синтез цитокинов макрофагами.
Для изучения процесса in vivo исследователи вводили CAR-T и опухолевые клетки мышам в брюшную полость. У животных при этом развивалась реакция, сходная с CRS у людей. При введении опухолевых клеток с выключенным газдермином Е этого не наблюдалось. Авторы также проанализировали уровень газдермина Е в клетках пациентов с ОЛЛ до введения CAR-T. Оказалось, что высокий уровень белка коррелировал с более серьезным проявлением CRS. У таких пациентов также было больше лактатдегидрогеназы в крови (выделяющейся из клеток при пироптозе), чем у пациентов с менее выраженным CRS.
Полученные результаты помогут разработать способы снижения побочного действия CAR T-клеточной терапии. Одним из таких способов может стать ингибирование газдермина Е в опухолевых клетках.
Источник
Yuying Liu et al. // Gasdermin E–mediated pyroptosis by CAR T cells triggers cytokine release syndrome. // Science Immunology, 2020; DOI: 10.1126/sciimmunol.aax7969


 Меню
Меню





 Все темы
Все темы




 0
0








