Полноценные циркадные часы цианобактерии собрали in vitro
Ученые из США дополнили существующую in vitro модель циркадных часов цианобактерии Synechococcus elongatus. К трем базовым циркадным белкам KaiA, KaiB и KaiC они добавили регуляторные белки SasA и CikA, транскрипционный фактор RpaA и фрагмент ДНК c RpaA-связывающим промотором. Новая система стабильно работает в широком диапазоне концентраций компонентов и позволяет наблюдать за их взаимодействиями.
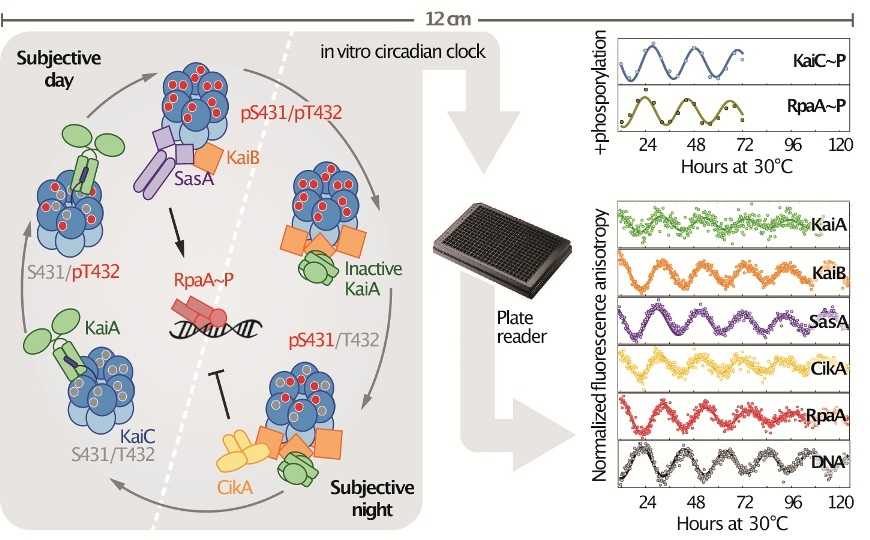
За циркадные ритмы цианобактерии Synechococcus elongatus отвечают три основных белка: KaiA, KaiB и KaiC. Белок KaiC, формирующий гексамерный комплекс, в течение дня фосфорилируется при участии KaiA. В течение ночи происходит его дефосфорилирование, опосредованное KaiB. Эти три белка — минимальный набор для реконструкции in vitro 24-часовых циклов фосфорилирования и дефосфорилирования KaiC.
Чтобы понять, каким образом циркадные часы контролируют экспрессию генов, ученые из США дополнили существующую in vitro систему транскрипционным фактором RpaA, двумя гистидиновыми киназами SasA и CikA, регулирующими активность RpaA при связывании с Kai-белками, а также фрагментом ДНК — промоторной областью, связывающей RpaA. Для наблюдения в реальном времени за взаимодействиями компонентов использовали явление анизотропии флуоресценции. К изучаемому белку пришивали флуоресцентную метку, и по изменению поляризации флуоресценции делали вывод о связанном или свободном состоянии белка. Метод позволяет следить за состоянием лишь одного белка в одной пробирке, но при параллельной постановке нескольких экспериментов с разными мечеными белками можно составить общую картину. Параллельно наблюдали также за АТФазной активностью KaiC и статусом фосфорилирования белков.
Новые циркадные часы поддерживали колебательный 24-часовой ритм с сохранением амплитуды в течение по крайней мере нескольких дней при мечении любого из компонентов системы. Система успешно воспроизводила исходы работы циркадных часов на всех уровнях до связывания транскрипционного фактора с ДНК.
С помощью этой системы ученым удалось подробнее выяснить роль SasA и CikA. Ранее было показано, что SasA фосфорилирует RpaA и стимулирует его связывание с ДНК днем, а CikA действует как фосфатаза и дефосфорилирует RpaA ночью. Удаление CikA не привело к исчезновению колебательных ритмов системы. Видимо, дефосфорилирование RpaA может происходить в автокаталитическом режиме или из-за слабой фосфатазной активности SasA. При удалении только SasA ритмы также сохранялись, но сокращались примерно на 3 часа. Это может объясняться киназной активностью CikA в свободном состоянии.
Предыдущие in vitro циркадные часы, состоящие из трех основных компонентов, работали только при определенных точно подобранных концентрациях. Добавление новых компонентов значительно увеличило устойчивость системы. Это означает, что CikA и SasA не только передают сигнал, но также могут влиять на связывание белков Kai. Для CikA такая функция рассматривалась ранее, и в новой работе ученые подтвердили ее. Кроме того, они показали, что и SasA способствует связыванию белков Kai. Так, KaiB в низких концентрациях плохо связывался с KaiC, но при добавлении SasA связывание улучшалось. Структурные исследования комплексов также косвенно подтверждают предположение.
Ученые также нашли объяснение потере циркадных ритмов у одного из штаммов S. elongatus. Оказалось, что однонуклеотидная мутация в гене rpaA, приводящая к замене аргинина на глутамин в позиции 121, нарушает связывание RpaA с ДНК, не затрагивая регуляторное связывание RpaA с SasA или CikA.
Сьюзен Голден, директор Центра циркадной биологии Калифорнийского университета в Сан-Диего и одна из авторов работы, считает, что истинная красота проведенной работы в том, как ученые из трех кампусов Калифорнийского университета объединили свои подходы, чтобы найти ответ на вопрос, как клетка узнает время. «Междисциплинарное взаимодействие было так же важно для успеха этого проекта, как и впечатляющие навыки исследователей», — говорит она.
Источник
Chavan, A.G., et al. Reconstitution of an intact clock reveals mechanisms of circadian timekeeping. // Science, 374, 6564, published 8 October 2021; DOI: 10.1126/science.abd4453


 Меню
Меню





 Все темы
Все темы




 0
0