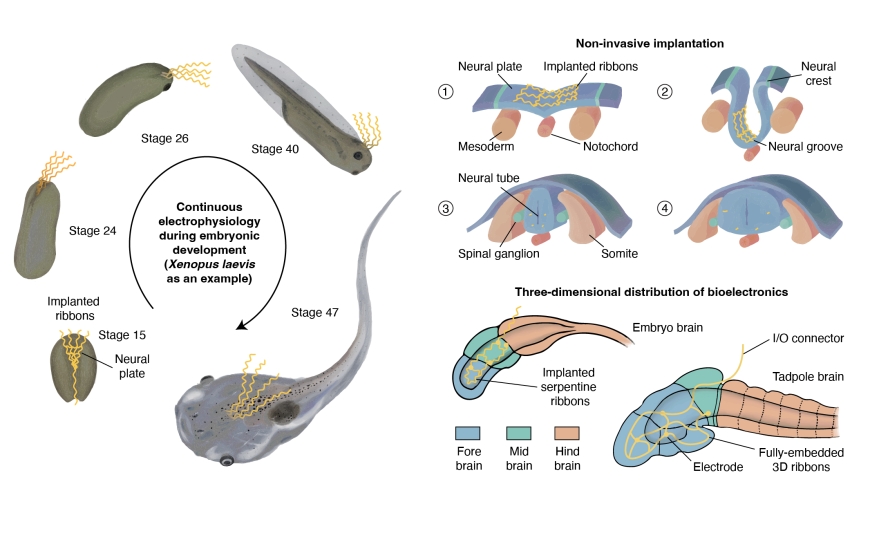
Раковые опухоли растут равномерно по всему объему
Авторы статьи в журнале eLife показали, что клетки опухоли печени делятся равномерно по всему объему новообразования, а не только на его поверхности, как предполагалось ранее. Этот вывод сделан на основе анализа пространственного распределения мутаций в образцах опухолей двух пациентов. Интересно, что среди мутационных сигнатур, которые удалось отследить авторам в клетках исследованных опухолей, самый сильной была сигнатура аристолохиевой кислоты, которая содержится в препаратах традиционной китайской медицины.
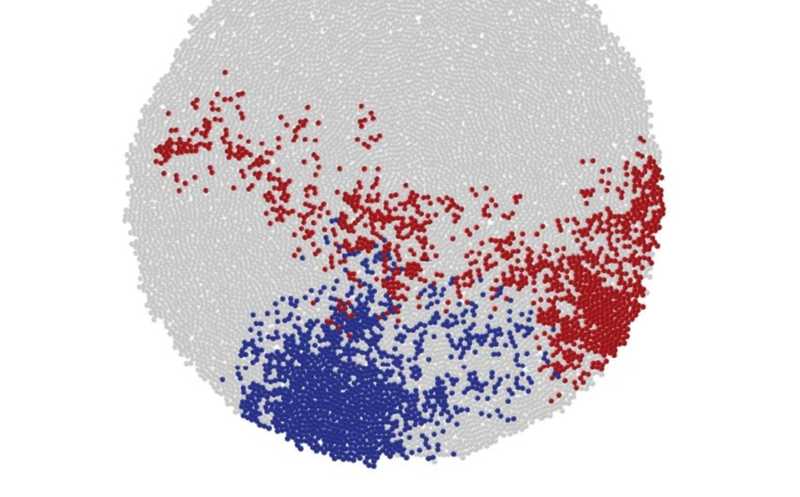
Компьютерное моделирование показывает, как клетки с той или иной мутацией группируются тесной колонией (синий) или распределяются по разным регионам опухоли (красный)
Credit:
eLife 13, RP95338 (2024). DOI: 10.7554/eLife.95338.2 | CC BY 4.0
Ученые из Кельнского университета, Центра геномной регуляции и Университета Помпеу Фабра в Барселоне продемонстрировали, что опухоли печени растут по всему своему объему — делятся не только поверхностные клетки, как предполагалось ранее. Этот вывод имеет большое значение для понимания механизмов развития рака и поиска новых подходов к его лечению.
В онкологии существуют две основные модели роста опухолей: поверхностная и объемная. Согласно модели поверхностного роста, клетки делятся в основном на границе опухоли, где лучше доступ к питательным веществам и кислороду, тогда как в центре повышены уровни метаболических отходов и механическое напряжение. Объемный рост предполагает равномерное деление всех клеток опухоли. Некоторые свидетельства поверхностного роста были получены из гистологических исследований, показывающих повышенный уровень белка Ki-67 (клеточный маркер пролиферации) на краю опухоли. Однако также были обнаружены случаи, когда уровни Ki-67 повышались в центре почечной карциномы.
Целью исследования было выяснить, какая из моделей роста реализуется в опухолях печени in vivo. Для этого ученые проанализировали данные о пространственном распределении мутаций в гепатоцеллюлярных опухолях. Генетические мутации, возникающие при делении клеток, можно использовать как маркеры для реконструкции истории развития опухоли.
Авторы использовали опубликованные данные о пространственном распределении мутаций в гепатоцеллюлярных карциномах. Материал включал два набора данных. В работе 2015 года исследовали клетки в 285 образцах из плоского среза опухоли; в 23 образцах провели полноэкзомное секвенирование, затем локусы с выявленными мутациями генотипировали во всех образцах и таким образом получили пространственное расположение клонов. Авторы второго исследования, опубликованного в 2021 году, проанализировали образцы из нескольких плоских срезов двух гепатоцеллюлярных опухолей одного и того же пациента — 169 образцов из одной опухоли и 160 из другой.
Для анализа распределения мутаций авторы предложили две метрики: угол между направлением роста дочернего мутантного клона относительно родительского (θ) и пространственную дисперсию клеток, несущих определенную мутацию (σ). Такой подход позволяет определить, происходит ли рост опухоли на поверхности или в объеме. При объемном росте углы направления имеют равномерное распределение, а значения дисперсии растут, когда клетки с мутацией вытесняются из места первоначальной локализации и распределяются в объеме опухоли. Если же объемного роста не наблюдается, то мутантные клоны образуют плотную колонию с низкими значениями дисперсии. Чтобы проверить гипотезы о поверхностном и объемном росте, исследователи использовали клеточную модель, учитывающую деление клеток, их гибель и мутации.
Анализ пространственного распределения мутаций в гепатоцеллюлярных карциномах не обнаружил признаков поверхностного роста с преимущественной пролиферацией на границе опухоли. Полученные результаты указывали на объемный рост — равномерное деление клеток независимо от их положения.
Дисперсия клеток, несущих одну и ту же мутацию, рассчитывается как отношение среднего расстояния между клетками с одной мутацией к среднему расстоянию для клеток, расположенных рядом друг с другом. Анализ данных секвенирования экзома из работы 2015 года показал, что среднее значение σ составляет около 3,5, а в некоторых случаях достигает 9. Это значительно превышает 1, что ожидалось бы при кластерном расположении клеток с одинаковыми мутациями. Авторы интерпретируют это как свидетельство высокого уровня перемешивания клеток в опухоли, вызванного объемным ростом.
Данные генотипирования позволили оценить уровень гибели клеток в опухоли (по доле клонов, для которых не обнаружены родительские клетки) и частоту мутаций. Уровень гибели клеток был почти таким же высоким, как и уровень деления. Это означает, что опухоль росла гораздо медленнее, чем можно было бы ожидать исходя из скорости деления клеток, и находилась в состоянии, близком к равновесию между ростом и гибелью. Частота мутаций на нуклеотид составила 1,6 × 10−8, что примерно в пять раз выше, чем у здоровых фибробластов человека.
Мутагенез в клетках опухоли происходит под воздействием различных факторов, для каждого из которых характерны мутации определенного типа (мутационная сигнатура). Самой сильной сигнатурой, которую удалось проследить в этой работе, оказалась SBS22, связанная с аристолохиевой кислотой. Оба пациента жили в Китае и, очевидно, лечились средствами традиционной китайской медицины, в которой применяются растения, содержащие это мутагенное вещество, например, кирказон. Авторы показали, что действие аристолохиевой кислоты на пациента из статьи 2015 года прекратилось в процессе эволюции опухоли, на более поздних стадиях.
Таким образом, клетки проанализированных опухолей росли равномерно по объему, без признаков пространственных ограничений, приводящих к радиальному росту. Рассеивание клонов с мутациями в объеме опухоли может быть полезным при исследовании ограниченного числа образцов, так как это повышает вероятность присутствия определенной мутации в выбранной для анализа области. Среди ограничений работы авторы отмечают прежде всего малое число исследованных опухолей. Возможно, разные типы опухолей и (или) опухоли на разных стадиях развития продемонстрируют другие режимы роста.
«Гамбит простака» предотвращает появление устойчивых к терапии опухолевых клеток
Источник
Arman Angaji, et al. High-density sampling reveals volume growth in human tumours // eLife 13, RP95338 (2024). DOI: 10.7554/eLife.95338.2


 Меню
Меню





 Все темы
Все темы



 0
0