Расшифрован молекулярный код, определяющий специфическое гликозилирование белка
В экспериментах на клеточных линиях ученые показали, что присоединение олигосахарида Lewis X к N-гликанам происходит не случайным образом. Фермент FUT9 узнает специфическую последовательность из 29 аминокислот, так называемый «код Lewis X», и пришивает олигосахарид в этом сайте.
Credit: Nagoya City University Graduate School of Pharmaceutical Sciences | Пресс-релиз
Все белки претерпевают ряд модификаций после трансляции. Благодаря им они приобретают большую стабильность или изменяют функции. Одна из таких модификаций, N-гликозилирование, представляет собой присоединение олигосахарида (гликана) к атому азота в белке. От N-гликозилирования зависит судьба клетки, однако его трудно предсказать и почти невозможно контролировать, так как информации о нем нет в геноме. Ученые из Японии и Тайваня нашли молекулярный код, который регулирует присоединение и отщепление олигосахарида Lewis X от внешних ветвей N-гликана.
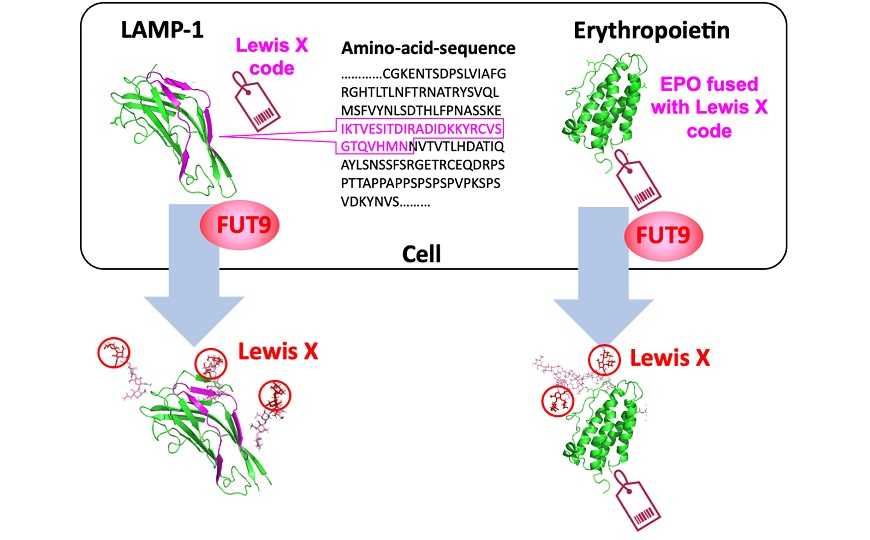
Lewis X имеет состав Gal-β(1,4)-[Fuc-α(1,3)]-GlcNAc. Образование Lewis X, опосредованное действием фукозилтрансферазы 9 (FUT9), способствует пролиферации нейральных стволовых клеток, а его исчезновение запускает дифференциацию. Ранее та же команда в экспериментах с мышиными нейральными стволовыми клетками обнаружила, что сначала Lewis X всегда появляется в мембранном белке LAMP-1. Ученые предположили, что существует молекулярный механизм, управляющий фукозилированием специфического субстрата.
Чтобы доказать существование механизма, они сверхэкспрессировали FUT9 в клетках линии CHO-K1 без Lewis X. Иммуноблоттинг с использованием антител к Lewis X и LAMP-1 подтвердил появление модификации только на этом белке, что соответствовало результатам предыдущих исследований. Нокдаун LAMP-1 приводил к исчезновению модификации. Такие же результаты были получены на клетках линий HEK293T и COS7.
На следующем этапе с помощью масс спектрометрии ученые определили сайты N-гликозилирования в LAMP-1, в которые FUT9 привносил фукозу, а затем экспрессировали в CHO-K1 серию мутантных LAMP-1, чтобы точно определить специфичную для Lewis X аминокислотную последовательность (так называемый код Lewis X). Ей оказался сегмент из 29 аминокислот в N-концевом домене белка, с Ile136 до Asn164. Авторы дали ему обозначение L29.
Для подтверждения функции L29 ученые вставили эту последовательность в C-концевой участок эритропоетина (EPO) и экспрессировали рекомбинантный EPO в CHO-K1. Фермент FUT9 взаимодействовал с EPO, что приводило к возникновению Lewis X в L29. При этом FUT9 фукозилировал EPO даже в бесклеточной системе, что говорит о независимости процесса от других компонентов клетки.
Таким образом, ученые определили сайт N-гликозилирования, который распознает белок FUT9 и вносит в него модификацию Lewis X. По мнению авторов, расшифровка «кода Lewis X» открывает большие перспективы в белковой и клеточной инженерии. Возможно, существует еще множество кодов, определяющих специфическое N-гликозилирование.
Ранее мы писали о том, как гликозилирование шаперона GRP94 изменяет его клеточную локализацию и функции.
Источник
Saito, T., Yagi, H., Kuo, CW., et al. An embeddable molecular code for Lewis X modification through interaction with fucosyltransferase 9. // Communication Biology 5, 676 (2022). DOI: 10.1038/s42003-022-03616-1


 Меню
Меню





 Все темы
Все темы




 0
0








