Рокаглаты делают макрофаги резистентными к Mycobacterium tuberculosis
Около четверти населения Земли являются носителями бактерий Mycobacterium tuberculosis (Mtb), однако заболевание, которое они вызывают — туберкулез — развивается у меньшинства, и центральную роль в устойчивости к заболеванию играют макрофаги. Mtb способна заражать макрофаги, избегая фагоцитоза — инфицированные макрофаги становятся резервуаром патогена в организме и способствуют развитию болезни. Ученые из Ирландии и США продемонстрировали, как чувствительные макрофаги, в которых Mtb способна персистировать, можно сделать резистентными с помощью рокаглатов и некоторых других соединений.
Макрофаги отвечают за устойчивость организма к Mycobacterium tuberculosis (Mtb) посредством различных эффекторных и иммунорегуляторных механизмов. Активация макрофагов регулируется лигандами патогенного происхождения и цитокинами, в том числе фактором некроза опухоли TNF. При этом сама M. tuberculosis способна инфицировать макрофаги организма-хозяина, избегая защитной реакции иммунной системы. В Science Advances опубликовали исследование, посвященное механизмам развития резистентности к туберкулезу в макрофагах. Ученые стимулировали развитие устойчивости к микобактериям в макрофагах, чувствительных к этим бактериям. Для этого они обрабатывали клетки рокаглатами (соединениями растительного происхождения, которые синтезируются различными видами красного дерева) и их синтетическими аналогами, ингибиторами JNK и ISR и другими соединениями. Совместное использование этих веществ давало синергетический эффект и позволяло использовать более низкие концентрации.
Исследование проводили на наивных макрофагах костномозгового происхождения, полученных от мышей B6, резистентных к Mycobacterium tuberculosis (R-макрофагах), и мышей B6.Sst1S, чувствительных к возбудителю туберкулеза (S-макрофагах). И те, и другие клетки оказались одинаково благоприятной средой для размножения Mycobacterium tuberculosis in vitro, но предварительная стимуляция макрофагов, полученных от Mtb-резистентных мышей, с помощью TNF повышала способность клеток бороться с бактериями. При этом TNF не влиял на резистентность макрофагов B6.Sst1S.
Секвенирование РНК показало, что стимуляция макрофагов TNF в обоих случаях приводила к значительным изменениям транскрипционного профиля, однако некоторое подмножество генов дифференциально экспрессировалось в S-макрофагах и R-макрофагах.
С помощью методов машинного обучения исследователи изучили переход наивных макрофагов из состояния чувствительности к Mycobacterium tuberculosis в состояние резистентности. Анализируя полученные данные, авторы пришли к выводу, что TNF в концентрации 10 нг/мл наиболее эффективно способствовал переходу R-макрофагов из восприимчивого состояния к устойчивому, но очень слабо влиял на S-макрофаги.
Далее к S-макрофагам, обработанным 10 нг TNF, добавляли различные вещества, способствующие повышению их устойчивости к микобактериям. Использованные малые молекулы ранее были выявлены этим же коллективом и включали ISRIB (ингибитор комплексной реакции на стресс), JNKi (ингибитор митоген-активируемых протеинкиназ, реагирующих на цитокины и другие факторы), рокаглат CMLD010536 и другие. После этого авторы также проводили секвенирование РНК.
Ученые проанализировали результаты секвенирования РНК с использованием методов машинного обучения, чтобы определить, какие соединения влияли на переход макрофагов из S-состояния в R-состояние. Таким веществом оказался синтетический рокаглат CMLD010536 (селективный ингибитор кэп-зависимой трансляции), который способствовал развитию резистентности к Mycobacterium tuberculosis в S-клетках. Ингибиторы JNK и интегрированный ингибитор реакции на стресс (ISRIB) и некоторые другие соединения существенно изменяли фенотип клеток, но не вызывали их переход из S- в R-состояние. Большинство других проанализированных соединений способствовали смещению транскриптомных паттернов макрофагов в сторону устойчивости к Mtb, но снижали восприимчивость макрофагов к воздействию TNF.
Далее ученые оценили совместное воздействие на S-макрофаги рокаглата CMLD010536 и ингибиторов JNKi и ISRIB. Все эти вещества подавляли гены, препятствующие развитию резистентности, и активировали гены, способствующие переходу из S- в R-состояние. В частности, CMLD010536 активировал Ifrd1, а JNKi и ISRIB активировали Stat1 и Gsdmd.
Рокагламид А (RocA) — рокаглат растительного происхождения — способствовал трансформации чувствительных макрофагов в резистентные, как и его синтетический аналог. Сочетание RocA с ISRIB не было синергично, в отличие от совместного использования RocA и JNKi — последняя комбинация RocA и JNKi вызывала более выраженный переход S-макрофагов в R-состояние. При этом усиливалась передача сигналов IL-1β, p38 и путей реакции на окислительный стресс. Обработка S-макрофагов субоптимальными концентрациями RocA и JNKi (1 нМ и 0,3 мкМ, соответственно) по отдельности приводила к активному размножению Mycobacterium tuberculosis, в то время как 3 нМ RocA или 1 мкМ JNKi эффективно снижали нагрузку Mtb в макрофагах. Совместное применение 1 нМ RocA и 0,3 мкМ JNKi давало синергетический эффект без повышения токсичности, способствуя пролиферации макрофагов и замедляя рост микобактерий.
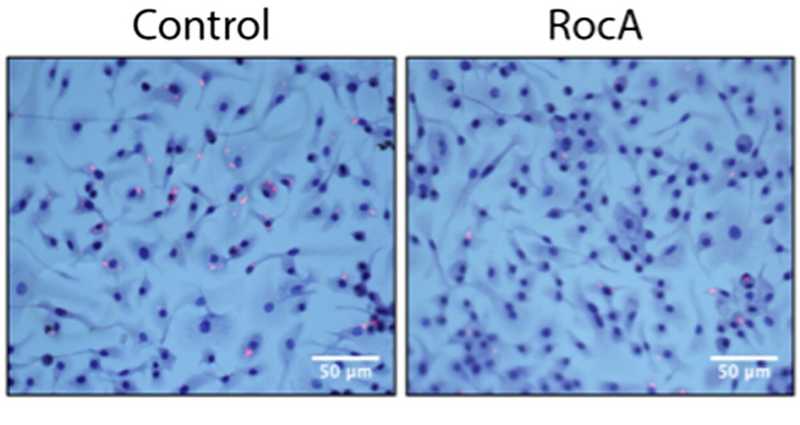 Обработка макрофагов рокагламидом А (RocA) уменьшила количество внутриклеточной Mycobacterium tuberculosis (окрашена розовым).
Обработка макрофагов рокагламидом А (RocA) уменьшила количество внутриклеточной Mycobacterium tuberculosis (окрашена розовым).Credit:
Science Advances (2023). DOI: 10.1126/sciadv.adh4119 | CC BY-NC
Исследование демонстрирует, что рокаглаты и ингибитор JNKi способствуют развитию резистентности к возбудителю туберкулеза у чувствительных к нему макрофагов. Кроме того, совместное действие этих соединений позволяет использовать более низкие их концентрации, снижая токсичность терапии.
Клеточные белки ATG7 и ATG14 ограничивают размножение микобактерии в макрофагах


 Меню
Меню





 Все темы
Все темы




 0
0








