Сбой при синтезе белков делает клетки меланомы более заметными для иммунной системы
Нарушение синтеза белка в опухолевых клетках приводит к повышенному производству неправильных пептидов, которые презентируются иммунным клеткам. Это делает опухоль более иммуногенной и позволяет успешнее с ней бороться. Международная группа ученых заставила раковые клетки образовывать больше аномальных пептидов, распознаваемых иммунной системой. Мишенью воздействия был фермент TYW2, в норме модифицирующий транспортную РНК.
Cancer Cell (2025). DOI: 10.1016/j.ccell.2025.03.003 | CC BY-NC-ND 4.0
Опухолевые антигены, вызывающие иммунный ответ, который способен уничтожить опухоль, возникают не только из-за мутаций в кодирующих белки участках ДНК. Когда в опухолевых клетках нарушен биосинтез белка (трансляция), множество неправильных пептидов презентируется молекулами главного комплекса гистосовместимости (MHC) на клеточной поверхности и распознается иммунной системой, в том числе Т-лимфоцитами. Это значительно повышает эффективность борьбы со злокачественными новообразованиями. Однако многие опухоли производят недостаточно «подозрительных» пептидов, поэтому до сих пор известно очень ограниченное количество антигенов, на которые можно было бы нацелить противоопухолевую терапию.
Международный коллектив ученых нашел способ заставить опухолевые клетки усиленно генерировать разнообразные патологические пептиды через индукцию сбоев в биосинтезе белка. Это может помочь в поиске новых антигенов-мишеней и повысить эффективность противораковой терапии. Результаты работы опубликованы в Cancer Cell.
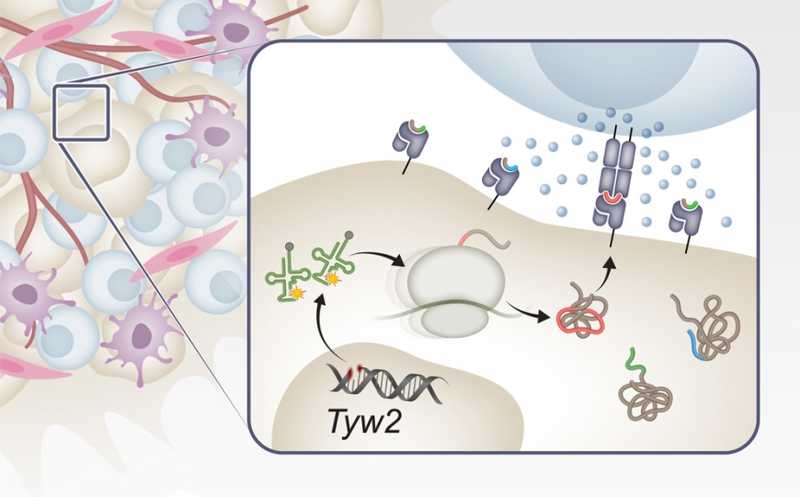
Функция тРНК-модифицирующих ферментов, которые регулируют стабильность тРНК и тем самым влияют на точность и эффективность синтеза белков — трансляцию, нарушена при многих типах рака, и это играет важную роль в прогрессировании онкозаболевания. Один из таких тРНК-модифицирующих ферментов — TYW2 (тРНК-уибутозинсинтезирующий белок 2). Его субстрат — тРНК, переносящая аминокислоту фенилаланин: TYW2 превращает гуанин в позиции 37 в уибутозин. Эта гипермодификация снижает вероятность сдвига рамки считывания при синтезе белка. Известно, что в некоторых типах опухолей TYW2 гиперэкспрессирован, а в других происходит его эпигенетический сайленсинг.
С помощью CRISPR-Cas9 ученые различными способами нокаутировали TYW2 в двух клеточных линиях меланомы A375 и SKMEL30. В клетках с нерабочим TYW2 фенилаланиновая тРНК не имела гипермодификации, что приводило к более частым сдвигам рамки считывания по сравнению с контрольными клетками и вызывало задержки рибосом на сайте фенилаланина при трансляции.
РНК-секвенирование и анализ генной онтологии показали, что в клетках с нокаутом TYW2 обогащены пути процессинга мРНК, а также процессинга и презентации антигенов. Сдвиги рамки считывания привели к образованию множества пептидов, специфичных для нокаутных клеток, которые презентируются молекулами главного комплекса гистосовместимости.
Ученые «накормили» такими аберрантными пептидами дендритные клетки, полученные от здоровых доноров, и культивировали их с мононуклеарными клетками периферической крови тех же доноров. Это способствовало активации и усилению цитотоксичности CD8+ Т-лимфоцитов. Среди неправильных пептидов было обнаружено два белковых фрагмента, более иммуногенных по сравнению с известными на данный момент опухолевыми антигенами, — они вызвали иммунный ответ у трех и пяти доноров из шести.
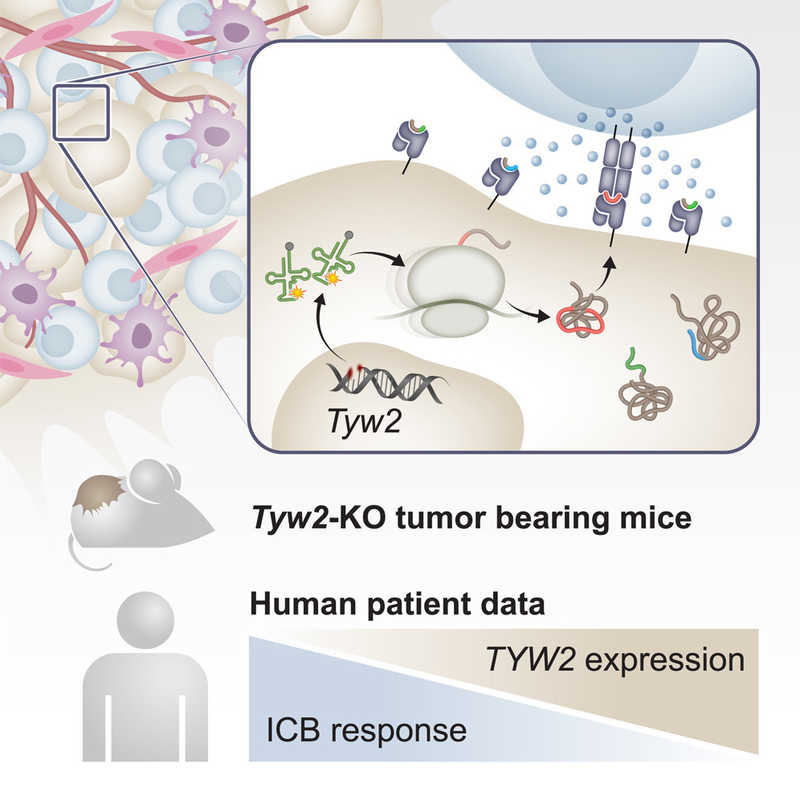
Переходя к экспериментам in vivo, ученые использовали систему CRISPR-Cas9 для нокаутирования TYW2 в клетках меланомы мышей. В отличие от клеток с отключенным TYW2, клетки с функциональным ферментом демонстрировали агрессивный рост, когда их привили животным с нормальной иммунной системой. Когда аналогичный опыт провели с мышами, у которых практически отсутствовали иммунные клетки, отличий в росте опухолей не наблюдалось. Истощения только CD8+ Т-лимфоцитов у мышей с нормальной иммунной системой оказалось достаточно, чтобы усилить развитие опухолей из клеток с нокаутом TYW2, что доказывает их ключевую роль в контроле TYW2-дефицитных опухолей. Совместное культивирование CD8+ Т-лимфоцитов с дендритными клетками, предварительно нагруженными лизатом TYW2-нокаутных опухолевых клеток, увеличивало их пролиферативную способность. А иммунизация десятью различными аберрантными пептидами делала CD8+ Т-лимфоциты мышей более активными в отношении опухолевых клеток с нокаутом TYW2.
В микроокружении TYW2-нокаутных опухолей у мышей с нормальной иммунной системой на 18-21-й день почти вдвое больше CD8+ Т-лимфоцитов по сравнению с контролем. Кроме того, в опухолях мышей с нокаутом TYW2 обнаруживалось меньше истощенных СD8+ Т-лимфоцитов и больше цитотоксических NK-клеток. Наконец, TYW2-нокаутная меланома оказалась более чувствительной к терапии ингибитором PD-1.
Эти результаты соответствуют известным фактам о TYW2 у онкопациентов. Так, согласно анализу данных из Атласа ракового генома (TCGA), более низкая экспрессия TYW2 связана с более высокой выживаемостью без прогрессирования пациентов с первичной меланомой. Напротив, у пациентов с более высокой экспрессией TYW2 общая выживаемость, как правило, ниже, хотя эта связь не была статистически значимой.
Таким образом, дефицит TYW2 ассоциирован с нарушением синтеза белка в опухолевых клетках и способствует производству более широкого разнообразия пептидов-антигенов, которые могут быть распознаны иммунной системой. Также усиливается процесс их презентации иммунным клеткам, что значительно повышает иммуногенность опухоли и позволяет эффективнее с ней бороться. Авторы надеются, что их работа будет способствовать разработке противоопухолевых препаратов на основе ингибиторов TYW2.
«Поскольку процесс трансляции одинаков в разных типах клеток, любая терапия, успешно нарушающая этот процесс в одном типе раковых клеток, может быть эффективным против многих других типов рака. Мы уже изучаем возможность нарушения процесса трансляции при раке молочной железы и поджелудочной железы, а также при колоректальном раке», — комментирует руководитель работы Ярдена Сэмюэлс из Института Вейцмана в Реховоте (Израиль).
Тройная иммунотерапия «разогрела» иммунологически «холодные» опухоли
Источники
Weller Chen, et al. Translation dysregulation in cancer as a source for targetable antigens // Cancer Cell (2025), DOI: 10.1016/j.ccell.2025.03.003
Цитата по пресс-релизу


 Меню
Меню





 Все темы
Все темы
 Credit: Cancer Cell (2025). DOI:
Credit: Cancer Cell (2025). DOI:




 0
0








