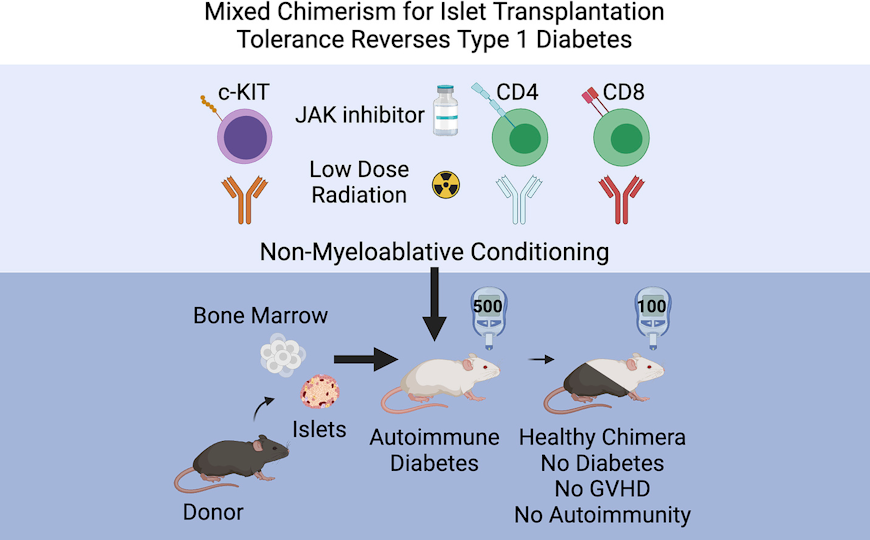
Смешанный химеризм и пересадка β-клеток устраняют симптомы диабета у мышей
Пересаженные для лечения диабета 1 типа β-клетки нередко отторгаются организмом пациента. Повысить их шансы на приживление помогает пересадка костного мозга, но она требует высокотоксичной подготовки. Чтобы решить эту проблему, ученые из США разработали щадящий режим, который позволяет безопасно сформировать смешанный гемопоэтический химеризм и обеспечить иммунотолерантность к тканям донора. Они использовали антитело к CD117, низкие дозы облучения и лимфодеплецию антителами. После такой подготовки мышам NOD — модели аутоиммунного диабета — пересаживали костный мозг и островковые клетки от здоровых мышей другой линии. Островковые клетки приживались и поддерживали нормальный уровень глюкозы в крови химерных мышей-реципиентов на протяжении всех 20 недель наблюдения.
Credit:
JCI (2025). DOI: 10.1172/JCI190034 | CC BY
Пересадка островковых клеток поджелудочной железы остается одним из наиболее перспективных подходов к лечению сахарного диабета 1 типа, однако ее применение серьезно ограничено постоянной необходимостью в иммуносупрессии и риском повторной гибели β-клеток. Исследователи активно изучают стратегию формирования смешанного кроветворного химеризма, при котором костный мозг донора и реципиента сосуществуют и перенастраивают иммунную систему на толерантность. Проблема в том, что трансплантация гемопоэтических стволовых клеток (ГСК) костного мозга сейчас проводится после высоких доз облучения или химиотерапии, которые слишком токсичны для применения при неонкологических заболеваниях. Ученые из США разработали более мягкий режим подготовки к трансплантации ГСК, который позволил пересадить ГСК и островковые клетки мышам NOD — классической модели аутоиммунного диабета, — сформировать у них химеризм и подавить проявления болезни.
Режим кондиционирования основан на антителе против CD117 — поверхностного рецептора ГСК, также известного как KIT. Его вводили мышам вместе с антителами к CD4 и CD8, которые позволяют временно истощить Т-клетки, и ингибитором JAK1/2 барицитинибом, а также подвергали мышей низким дозам облучения. Такая комбинация не была миелоаблативной, но эффективно освобождала ниши в костном мозге, позволяя прижиться трансплантированным ГСК.
У мышей NOD с преддиабетом, которым пересаживали костный мозг и островки от мышей линии C57BL/6, этот режим позволил добиться стабильного смешанного химеризма. Химерные животные не демонстрировали признаков реакции «трансплантат против хозяина» (РТПХ), у них быстро восстанавливалось кроветворение и не развивался диабет. Их островки были защищены от аутоиммунной инфильтрации, и трансплантированные β-клетки сохранялись без повреждений. Однако островки, пересаженные не от мыши-донора ГСК, а от третьей мыши, отторгались — это важный признак сохранной иммунокомпетентности.
Далее исследователи воспроизвели наиболее критичную клиническую ситуацию — лечение уже развившегося диабета. Мышам NOD с длительной (2 недели и более) гипергликемией одновременно пересаживали костный мозг и островки от здоровых мышей C57BL/6 (островки вживляли в почку). Это также обеспечивало стабильный смешанный химеризм. Наблюдение после трансплантации вели 20 недель, в течение этого времени у мышей-реципиентов поддерживалась нормогликемия. Они не нуждались ни в инсулине, ни в иммуносупрессии.
Когда почку с трансплантатом удаляли, диабет возвращался, что подтверждает терапевтическую пользу донорских островков. Островки третьей мыши при этом отторгались, подтверждая, что иммунная система не была патологически подавлена.
Авторы обнаружили, что после трансплантации у мышей практически исчезали аутореактивные T-клетки, специфичные к IGRP — аутоантигену β-клеток. Также иммунологические исследования выявили наличие донорских антигенпрезентирующих клеток в тимусе и усиление как центральных, так и периферических механизмов толерантности, включая экспансию регуляторных Т-клеток и формирование анергичных Т-клеток.
Таким образом, щадящий режим кондиционирования, предложенный авторами работы, позволяет сформировать смешанный кроветворный химеризм при пересадке костного мозга. Он устраняет аутоиммунные реакции и способствует формированию иммунотолерантности к донорским клеткам — без токсичности, РТПХ и необходимости в пожизненной иммуносупрессии. Предложенная схема лечения избавила мышей NOD от аутоиммунного диабета, что открывает перспективу ее клинического применения.
Клетки желудка человека впервые заставили секретировать инсулин
Источник
Bhagchandani P., et. al. Curing autoimmune diabetes in mice with islet and hematopoietic cell transplantation after CD117 antibody-based conditioning. // Journal of Clinical Investigation (2025), published online 18 November 2025. DOI: 10.1172/JCI190034


 Меню
Меню





 Все темы
Все темы



 0
0