Стареющие клетки способствуют дифференцировке опухолевых клеток в нейроэндокринные
Ученые из Франции описали новую роль сенесцентно-ассоциированного секреторного фенотипа. Клеточные линии рака молочной железы под влиянием сенесцентных фибробластов дифференцировались в нейроэндокринные клетки. Этот процесс зависит от активности p53, экспрессии рецептора эстрогена и активности сигналинга кальция.
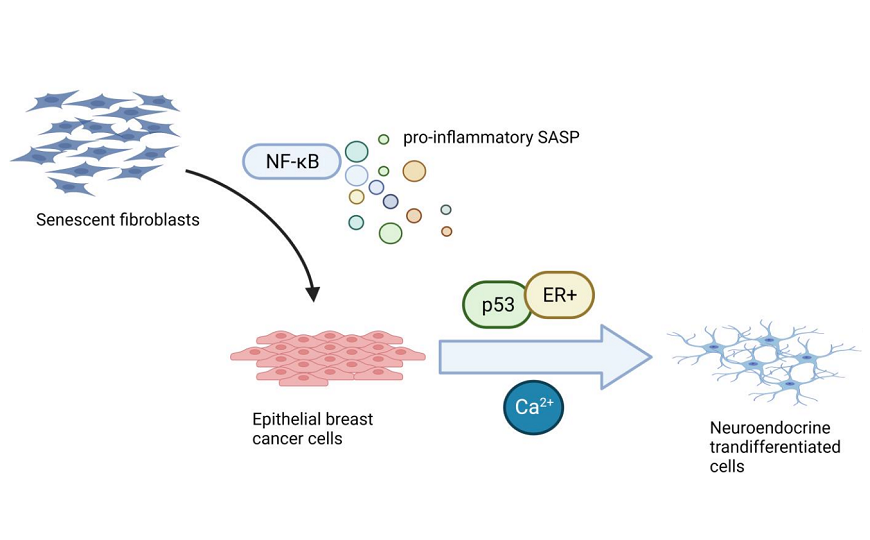
Сенесцентные клетки — это стареющие или поврежденные клетки, безвозвратно утратившие способность к делению. Они могут накапливаться в различных тканях и органах, способствуя старению и возрастным заболеваниям. Для этих клеток характерен так называемый сенесцентно-ассоциированный секреторный фенотип (SASP); они выделяют молекулы, которые могут оказывать как благотворное, так и пагубное влияние на окружающие клетки и ткани. Например, такие молекулы могут стимулировать сенесцентность в окружающих клетках, стимулировать или подавлять стволовость клеток, модифицировать внеклеточный матрикс, активировать или подавлять иммунный ответ, а также стимулировать эпителиально-мезенхимальный переход, способствуя миграции клеток. Исследователи из Франции обнаружили новую роль SASP: сенесцентные фибробласты могут стимулировать дифференцировку опухолевых клеток рака молочной железы (РМЖ) в нейроэндокринные клетки. Этот процесс называется нейроэндокринной трансдифференциацией (НЭТ). Известно, например, что такие клетки участвуют в возникновении резистентности к терапии в раке простаты.
Чтобы изучить влияние SASP на опухолевые клетки РМЖ, авторы собрали среду, в которой культивировались сенесцентные фибробласты человека, и добавили ее к клеточным линиям РМЖ. Они обнаружили, что те клетки, которые не имели мутаций в гене TP53 и экспрессировали рецепторы эстрогена, также стали сенесцентными. Кроме того, в таких клетках была повышена экспрессия нейроэндокринных маркеров SCG2 и CHGB. Кроме того, SASP также индуцировал похожий эффект в клетках рака простаты, не имеющих мутаций в TP53. Интересно, что клетки РМЖ и рака простаты, имеющие мутации в TP53, не демонстрировали признаков дифференциации в нейроэндокринные клетки, в связи с чем авторы заключают, что функциональная активность p53 необходима для НЭТ.
Известно, что SASP регулируется несколькими сигнальными путями, включая NF-κB, mTOR, C/EBPβ, p38MAPK и другие. NF-κB является ключевым регулятором воспалительного SASP. Ингибируя NF-κB и снижая уровни провоспалительных молекул SASP, удалось частично обратить вспять НЭТ.
Мало что известно о молекулярной регуляции НЭТ. Ранее было сделано предположение, что в этом процессе могут быть задействованы сигнальные пути с участием кальция. Авторы обнаружили повышенное содержание кальция в стареющих клетках НЭТ, в основном во внутриклеточных запасах. Более того, благодаря буферизации кальция, нейроподобные структуры и экспрессия нейроэндокринных генов были частично обращены вспять.
Следующим шагом авторы использовали базу данных Molecular Taxonomy of Breast Cancer International Consortium (METABRIC) и изолировали опухоли, которые экспрессировали нейроэндокринные маркеры SCG2, CHGB, CHGA и SYP. В результате из 1904 опухолей, включенных в базу данных, были выделены 45. Анализ различий генной экспрессии эндокринных и неэндокринных опухолей показал повышенную активность молекулярных сигнатур процессов, связанных с НЭТ, таких как транспорт нейромедиаторов. Кроме того, в таких опухолях была также повышена активность сигналинга кальция. Все опухоли и экспрессировали рецепторы эстрогена и по большей части не имели мутаций в TP53, что сходится с экспериментальными результатами авторов. Доля нейроэндокринных опухолей молочной железы увеличивалась с возрастом, что можно объяснить накоплением сенесцентных клеток, со временем способствующих развитию НЭТ.
Таким образом, исследователи идентифицировали новую роль SASP в индуцировании НЭТ в клетках РМЖ. По-видимому, этот процесс зависит от сигнального пути NF-κB и сигналинга кальция.
Источник:
Hunda A., et al. The senescence-associated secretory phenotype induces neuroendocrine transdifferentiation // Aging. Published online 17 April 2023, DOI: 10.18632/aging.204669








 Меню
Меню





 Все темы
Все темы





 0
0