Создан атлас старения скелетных мышц
Старение организма сопровождается атрофией мышц. Участники проекта Human Cell Atlas исследовали мышечные ткани людей и мышей разного возраста и представили результаты в виде атласа старения скелетных мышц, описывающего процессы, которые лежат в основе возрастной саркопении, и возможные компенсаторные механизмы.
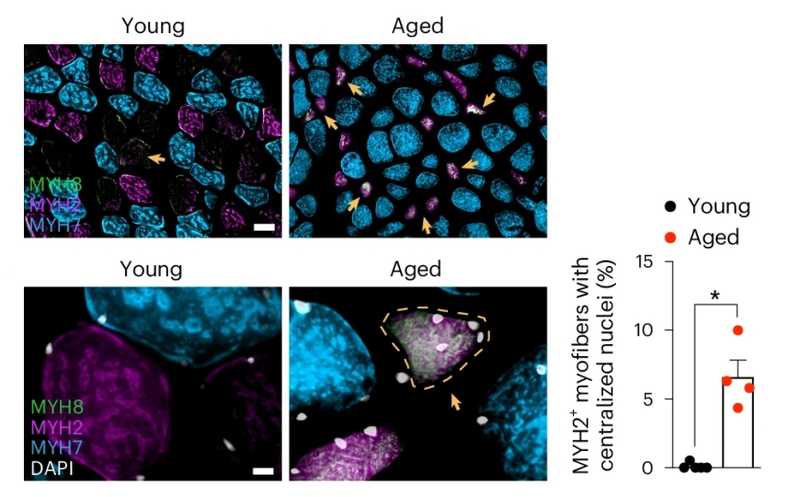
Иммунофлуоресцентное мечение маркеров различных типов мышечных волокон. Справа доли миофибрилл MYH2+ с централизованными ядрами (признак регенерации) от всех миофибрилл MYH2+ у молодых и пожилых. Стрелки указывают на миофибриллы, экспрессирующие MYH8 (их появление — еще один компенсаторный механизм).
Credit:
Nature Aging. 2024 Apr 15. DOI: 10.1038/s43587-024-00613-3 | CC BY 4.0 DEED
На скелетные мышцы приходится 40% массы тела человека. Главные компоненты скелетных мышц — многоядерные мышечные волокна (MF), которые делятся на два основных типа: медленные (I типа) и быстрые (II типа) нескольких видов. Мышечные волокна окружены мононуклеарными мышечными стволовыми клетками (MuSC), которые при повреждениях служат источником новых MF. Микроокружение мышечных волокон включает в себя фибробласты, систему сосудов, иммунные клетки, шванновские клетки и аксоны нейронов.
Старение организма сопровождается саркопенией — потерей мышечной массы и снижением силы; это одна из причин, по которой пожилые люди часто падают и получают травмы. Саркопения — прежде всего результат уменьшения в количестве и размерах быстрых мышечных волокон, но почему и как это происходит, до сих пор неизвестно.
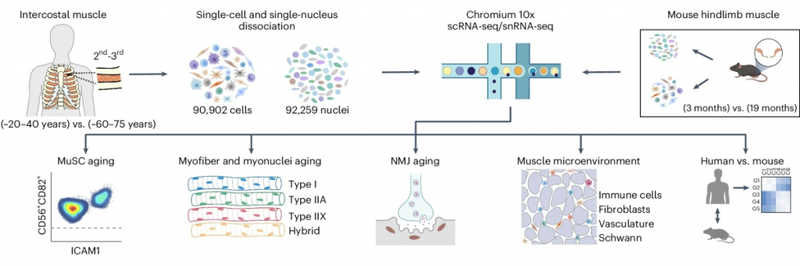
Ученые из Института Уэллкома — Сэнгера (Великобритания) и Университета Чжуншань имени Сунь Ятсена (Китай) проанализировали транскриптомы мышечных волокон, мышечных стволовых клеток и клеток микроокружения мышц и выявили факторы, способствующие старению мышечной ткани. По результатам секвенирования стволовых мышечных клеток, ядер мышечных волокон и клеток их микроокружения был создан атлас старения скелетных мышц. Эта работа — часть проекта «Атлас клеток человека» (Human Cell Atlas).
Для исследования брали образцы межреберных мышц (участки между вторыми и третьими ребрами) у посмертных доноров органов и у пациентов во время торакальных операций, образцы мышц нижних конечностей абортированного эмбриона человека (19-я неделя после зачатия) а также мышц задних конечностей мышей (3-месячных и 19-месячных самцов, линия C57BL/6JRj). Скелетную мышечную ткань измельчали и обрабатывали раствором коллагеназы II и диспазы, после чего выделяли фракцию одиночных клеток и отдельно — интактные клеточные ядра. Для подготовки образцов к секвенированию транскриптомов одиночных клеток (scRNA-seq, исследование одноклеточной РНК) и интактных ядер (snRNA-seq, исследование одноядерной РНК) использовали станцию Chromium Controller (10x Genomics); библиотеки кДНК создавали с помощью набора реагентов Single Cell 3' v2 или v3 Reagent Kit; секвенировали на системах Illumina HiSeq 4000 или NovaSeq 6000.
 Credit: Nature Aging, 2024, DOI:
10.1038/s43587-024-00613-3.
Credit: Nature Aging, 2024, DOI:
10.1038/s43587-024-00613-3.
В ходе исследования были идентифицированы мононуклеарные стволовые мышечные клетки, фибробласты, гладкомышечные клетки, перициты, эндотелиальные клетки, адипоциты, миелинизирующие и немиелинизирующие шванновские клетки и многоядерные мышечные волокна. Технология scRNA-seq оказалась более эффективной для иммунных, сосудистых и шванновских клеток, а snRNA-seq — для адипоцитов и ядер мышечных волокон, что демонстрирует преимущество объединения методик.Результаты секвенирования оценивали с использованием Cell Ranger 3.1.0, а также эталонных геномов человека GRCh38-3.0.0 и мыши mm10-1.2.0. Для оценки влияния возраста на состав клеток использовались два подхода — модель регрессии Пуассона со смешанными эффектами и фреймворк MiloR (v.1.2.0).
Исследователи профилировали транскриптомы 90902 клеток и 92259 ядер из биопсий межреберных мышц 8 молодых (20–40 лет) и 9 пожилых (60–75 лет) доноров, а также 68956 клеток и 27573 ядер мышц мышей (пяти трехмесячных и трех 19-месячных животных).
Ученые выделили четыре субпопуляции мышечных стволовых клеток: покоящиеся мышечные стволовые клетки (Main MuSC), активированные стволовые клетки, участвующие в регенерации мышц (TNFRSF12A+ MuSC), (стволовые клетки, активно экспрессирующие цитокины (ICAM1+ MuSC) и субпопуляцию дифференцирующихся стволовых клеток (MYOG+ MuSC), которая скорее всего является артефактом, образующимся в процессе обработки тканей.
Подтвердилось снижение активности генов сборки рибосом на уровне транскрипции и трансляции у пожилых людей по сравнению с молодыми; это приводит к дефектам сборки рибосом и старению стволовых клеток. У миобластов (молодых миоцитов) пожилых людей есть и другие маркеры старения: рост активности ингибиторов циклинов, а также активности маркеров старения бета-галактозидазы и секреторного фенотипа, связанного со старением (SASP). В то же время в них активируется ген провоспалительного цитокина CCL2, экспрессия которого регулируется ключевым медиатором воспаления, фактором транскрипции NFKB1; это объясняется снижением уровня ингибиторов NFKB1 и ростом его активатора. Все эти процессы в целом способствуют нарушению иммунного гомеостаза и развитию хронического воспалительного процесса.
Исследования показали, что в многоядерных мышечных волокнах по мере старения уменьшается количество ядер, но с возрастом быстрые мышечные волокна дегенерируют активнее, чем медленные. У пожилых людей почти полностью исчезают самые быстрые волокна IIX типа, а волокна IIA типа сильнее всего уменьшаются в поперечном сечении. В медленных волокнах повышалась экспрессия генов, кодирующих гликолитические ферменты, и снижалась активность генов митохондриального биогенеза. Обнаружены также компенсаторные механизмы, такие как увеличение в медленных мышечных волокнах экспрессии генов, характерных для быстрых волокон.
В стареющих мышечных волокнах становится меньше кластеров рецепторов ацетилхолина в области синапса, в микроокружении снижается количество аксонов. В целом в образцах мышц пожилых людей по сравнению с клетками молодых доноров оказалось больше подтипов иммунных клеток (NK-, Т-, В-лимфоцитов) и тучных клеток, но меньше сосудистых (гладкомышечных, клеток артериального и капиллярного эндотелия) и шванновских клеток. Эти данные согласуются с результатами других исследований, в которых были продемонстрированы возрастная инфильтрация иммунных клеток для многих тканей, а также возрастная денервация и снижение васкуляризации ряда органов.
Интегрированный анализ данных исследований старения мышц у человека и мыши показал, что в стареющих мышечных клетках обоих видов подавлена экспрессия значительного количества генов, в том числе кодирующих сигнальные пути, задействованные в росте мышц, иннервации, межклеточных взаимодействиях; в то же время активированы провоспалительные гены.
Дальнейшие исследования в этой области предполагают поиск новых методов борьбы с возрастной саркопенией и разработку методов лечения атрофии мышц на фоне старения.
Источник
Kedlian V.R. et al. Human skeletal muscle aging atlas // Nature Aging. 2024 Apr 15. DOI: 10.1038/s43587-024-00613-3.


 Меню
Меню





 Все темы
Все темы




 0
0








