Telomouse — мышь с теломерами человеческих размеров
У двух близкородственных видов мышей — Mus musculus и M. spretus — длина теломер различается в пять раз. В работе, опубликованной в Nature Communications, показано, что замена метионина в положении 492 гена Rtel1 M. musculus на лизин, характерный для M. spretus, приводит к постепенному уменьшению длины теломер из поколения в поколение до стабилизации на уровне, сравнимом с человеческим. Длина теломер у таких мышей (Telomouse) варьирует в широких пределах и может быть меньше двух килобаз, однако такие теломеры по-прежнему остаются функциональными. В работе была доказана роль RTEL1 в контроле длины теломер и получена новая модель для изучения рака и старения.
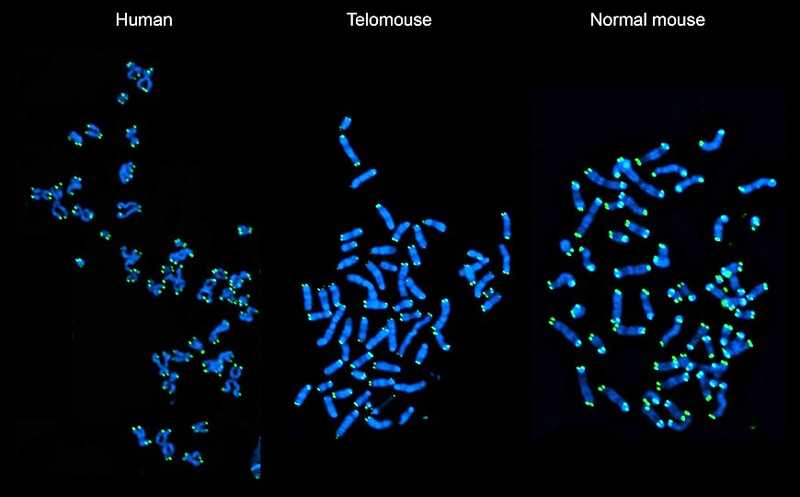
Длина и интенсивность свечения теломер (зеленые) у Telomouse похожи на человеческие (слева), а не на мышиные (справа).
Credit:
Yehuda Tzfati | Пресс-релиз
Теломеры поддерживают геномную стабильность и способствуют пролиферации клеток. В большинстве соматических клеток человека теломеры укорачиваются при каждом делении и достраиваются теломеразой до характерной для вида длины в зародышевых клетках. До сих пор не до конца понятно, как поддерживается гомеостаз длины теломер. У двух близкородственных видов мышей (Mus musculus и M. spretus) длина теломер отличается в пять раз. Они не раз становились предметом исследования при поиске генов, определяющих длину теломер. Считается, что за этот параметр у мышей отвечает кодирующий ДНК-хеликазу локус — Regulator of Telomere Length (Rtel1). Но различия в RTEL1 двух видов, отвечающих за разную длину теломер, пока не были идентифицированы.
Хеликазы, подобные RTEL1, ранее связывали с различными заболеваниями, такими как пигментная ксеродермия. У человека мутации в обоих аллелях RTEL1 приводят к развитию смертельно опасного заболевания, характеризующегося ускоренным укорачиванием теломер. Одна из таких мутаций — замена метионина в положении 492 на изолейцин. Метионин в этом положении высоко консервативен у позвоночных, только у нескольких видов (в основном кошек) там находится лейцин. У M. spretus в положении 492 находится лизин. Авторы работы, опубликованной в Nature Communications, предположили, что именно этот лизин отвечает за различия в длине теломер между двумя видами.
Чтобы понять роль метионина в положение 492 (M492), авторы сначала создали структурную модель мышиной хеликазы RTEL1, а также смоделировали комплекс с одноцепочечной ДНК. Оказалось, что M492 расположен в глубине ядра хеликазного домена и вблизи сайта связывания одноцепочечной ДНК. Он имеет гидрофобные контакты с остатками M464, V468, F488 и I494. Замена на более крупный и положительно заряженный лизин, скорее всего, нарушит местные связи.
Чтобы проверить эту гипотезу, авторы получили мышей M. musculus с заменой M492K, используя систему CRISPR. Мышь с двумя мутантными аллелями они назвали Telomouse. Средняя длина фрагментов рестрикции теломер у мышиных эмбриональных фибробластов животных дикого типа составила 37,8 kb после 250 удвоений популяции. У мутантной гетерозиготы в это же момент времени средняя длина фрагментов рестрикции теломер составила 21,6 kb, а у гомозигот — 14,7 kb. В среднем этот показатель снизился на 60% у Telomouse и достиг значений, сравнимых с человеческими иммортализированными фибробластами. Дополнительный анализ подтвердил, что причина укорачивания теломер — не в случайной их делеции, а в снижении активности теломеразы.
Есть опасения, что длина фрагментов рестрикции теломер не отражает длину теломерных повторов с достаточной точностью. Метод qFISH подтвердил, что средняя интенсивность сигналов от теломер у Telomouse была сравнима или ниже, чем у человеческих теломер. У Telomouse сигналы от теломер варьировали в более широких пределах, часть сигналов была ниже предела детекции. Однако авторы подчеркнули, что необходим более точный метод оценки истинной длины теломерных повторов, особенно самых коротких.
Исследователи разработали новый метод оценки длины теломер с помощью нанопорового секвенирования — NanoTelSeq. Для этого они адаптировали ранее разработанный метод STELA. Новый метод показал, что медиана длины теломер у Telomouse составляет 5,6 kb после 250 удвоений, у мышей дикого типа — 27,3 kb, у человека — 9,47 kb.
У Telomouse были выявлены теломеры короче трех и даже двух килобаз. Однако авторы показали, что даже такие короткие теломеры являются функциональными.
Теломеры укорачиваются в культивированных фибробластах Telomouse, но это не значит, что то же самое происходит в зародышевых клетках или соматических тканях мышей. Авторы проанализировали длину теломер в клетках крови и хвоста 13 поколений Telomouse. В крови у Telomouse средняя длина фрагментов рестрикции теломер составила 16,7 kb, у мышей дикого типа — 39,7 kb. В хвосте — 19,3 и 42,6 kb соответственно. При сравнении двух поколений — F15 и F16 — не было показано дальнейшего укорачивания теломер, то есть их длина стабилизировалась. Это говорит о том, что теломеразная активность не была выключена, она просто ослабла.
У Telomouse не было проблем с фертильностью по крайней мере до F16, что говорит о достаточной длине теломер в зародышевых клетках. Однако дальнейшие опыты показали, что способность к регенерации у них была нарушена. Вероятно, дело в коротких теломерах и недостаточной активности теломеразы в соматических тканях.
Таким образом, исследователи получили новый штамм мышей M. musculus — Telomouse — с укороченными теломерами, размерами напоминающие человеческие. Размеры теломер уменьшались с каждым поколением на примерно одну килобазу за поколение, пока не пришли к новому значению, после чего стабилизировались. Это демонстрирует роль мутации M492K на функционирование RTEL1 и на длину теломер у вида. Также Telomouse — новая интерсная модель для изучения рака и старения.
Более короткие теломеры лейкоцитов ассоциированы с развитием деменции
Источник:
Riham Smoom, et al. Telomouse—a mouse model with human-length telomeres generated by a single amino acid change in RTEL1 // Nature Communications 14, 6708 (2023), October 23, 2023, DOI: 10.1038/s41467-023-42534-6


 Меню
Меню





 Все темы
Все темы




 0
0








