Туберкулезная микобактерия с аварийным выключателем позволит изучать вакцины от туберкулеза на людях
Разработка вакцин от туберкулеза затруднена отсутствием надежных животных моделей. Исследования можно проводить на людях, однако при этом необходим строгий контроль размножения патогена. Ученые из США получили штамм палочки Коха с тройным «предохранителем» — модификация генома делает бактерии жизнеспособными только в присутствии определенных препаратов. Модифицированные бактерии инфицировали модельных мышей при введении контролирующих агентов, вызывая иммунный ответ, однако при отмене препаратов они полностью выводились из организма за 84 дня. Авторы считают, что полученный штамм достаточно безопасен для исследований на людях.
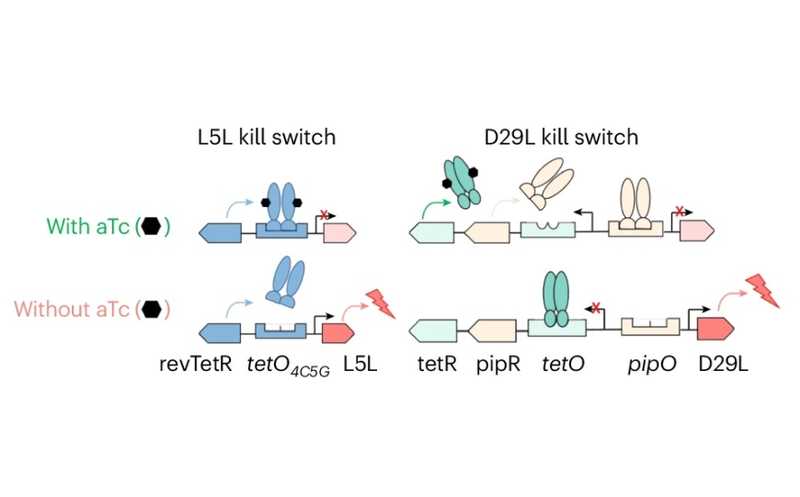
Принцип работы «аварийного выключателя» для туберкулезной палочки: ангидротетрациклин (aTc) обеспечивает репрессию литического фермента бактериофага, внедренного в бактерию. В отсутствие aTc литический фермент экспрессируется, вызывая гибель клетки.
Credit:
Nature Microbiology (2025). DOI:
10.1038/s41564-024-01913-5 |
CC BY
Туберкулез остается одной из ведущих инфекционных угроз. Единственной одобренной к использованию вакциной на данный момент является Бацилла Кальмета — Герена (БЦЖ), которая показывает нестабильную эффективность на взрослой популяции. Разработка новых вакцин осложняется отсутствием надежных животных моделей инфекции. Один из вариантов решения проблемы — исследования на добровольцах с контролируемым инфицированием, в которых людей заражают инфекционным агентом для оценки эффективности вакцины или терапии. При таком подходе на первую роль выходит безопасность участников — инфекционный агент должен иметь строго определенные рамки репликации, внутри которых он, однако, должен достаточно хорошо воспроизводить дикий тип патогена. В статье, опубликованной в Nature Microbiology, представлен модифицированный штамм Mycobacterium tuberculosis (палочка Коха) с тройной системой «предохранителей», позволяющей контролировать его репликацию в организме.
Сперва авторы разработали двойную систему, основанную на контроле экспрессии литических ферментов двух интегрированных в бактерию микобактериофагов (L5 и D29). Аналогичным подходом воспользовались ученые, создавшие более безопасные штаммы БЦЖ для вакцинации — их работа была опубликована в Nature Microbiology в тот же день. Экспрессию транскрипции контролировали за счет системы устойчивости к тетрациклину, имеющейся у грамотрицательных бактерий. В присутствии антибиотика активируется транскрипция генов, выводящих тетрациклин из клетки. Задействованные в системе промоторы и репрессоры можно использовать для контроля экспрессии целевых генов генов, активируя ее либо в присутствии препарата, либо, наоборот, в его отсутствие.
В данном случае модифицированный штамм мог реплицироваться только в присутствии ангидротетрациклина (aTC), при удалении которого из среды запускалась экспрессия фагового литического фермента, что приводило к гибели бактерий. В in vitro условиях скорость снижения количества бактерий — логарифмическое сокращение численности — составила около одной колониеобразующей единицы (CFU) за каждые три дня (что соответствует снижению численности в 10 раз). На мышиной модели модифицированный штамм успешно инфицировал животных при введении доксициклина (который в данном случае функционировал аналогично aTC). При отмене антибиотика логарифмическая численность бактерий в легких и селезенке снижалась со скоростью 0,50 и 0,35 CFU в неделю, соответственно. Расчетный темп образования мутаций, нарушающих функциональность системы, составил 8,8×10−9 на геном на поколение. Этот показатель был хуже желаемого, поэтому авторы решили дополнить систему третьим предохранителем.
Ученые адаптировали систему, разработанную ранее для контролируемой деградации белков в нервной системе млекопитающих. В ней белок-мишень модифицируется специальными деградаторами, которые нарушают его структуру. Триметоприм (TMP, антибиотик, неэффективный против палочки Коха) связывается с деградаторами и стабилизирует структуру белка. Авторам удалось внедрить систему в Mycobacterium tuberculosis — бактерии размножались в присутствии TMP, а при удалении его из среды численность резко сокращалась.
Штамм TKS (triple kill-switch), несущий все три системы, практически не отличался от дикого типа в присутствии TMP и aTC в in vitro тестах. При удалении обоих агентов скорость сокращения логарифмической численности составила около 3 CFU в неделю с полной стерилизаций культуры за 11 дней. Скорость возникновения мутаций, позволяющих бактериям «сбежать» из-под контроля в отсутствие обоих антибиотиков, составила менее менее 3,8×10−10, то есть была ниже предела обнаружения.
На мышиных моделях штамм TKS инфицировал животных, получавших доксициклин и TMP с пищей. При отмене препаратов наблюдалось бактериальная нагрузка в легких исчезала через 68 дней, в селезенке через 84 дня (у одного животного даже быстрее — уже через 28 дней). Во время инфекции наблюдался Т-клеточный ответ, при котором в зараженные ткани привлекались активированные эффекторные Т-клетки и клетки памяти. После очищения инфекции иммунная система возвращалась в состояние, неотличимое он неинфицированных животных. Наконец, при повторном введении доксициклина и TMP через 84 дня после прекращения первичного эксперимента не происходило рецидива заболевания — живых палочек Коха в организме не наблюдалось. Контролировать штамм TKS удавалось и в отсутствие врожденного иммунитета — это подтвердили в опытах на иммунодефицитных мышах.
По мнению авторов, разработанный штамм с тройным «предохранителем» отвечает требованиям для исследований с контролируемым инфицированием добровольцев.
Источник
Wang, X., et al. Engineered Mycobacterium tuberculosis triple-kill-switch strain provides controlled tuberculosis infection in animal models // Nat Microbiol, published January 10, 2025, DOI: 10.1038/s41564-024-01913-5


 Меню
Меню





 Все темы
Все темы




 0
0








