Ученые определили структуру транспортера марганца у пневмококка
В журнале Science Advances опубликована статья о механизме захвата марганца клетками Streptococcus pneumoniae из организма хозяина. Главный участник процесса — белковый комплекс PsaBC, который относятся к ABC-пермеазам. С помощью рентгеноструктурного анализа авторы определили строение PsaBC. Они предположили, что блокировка канала поможет в борьбе с антибиотикорезистентными пневмококками.
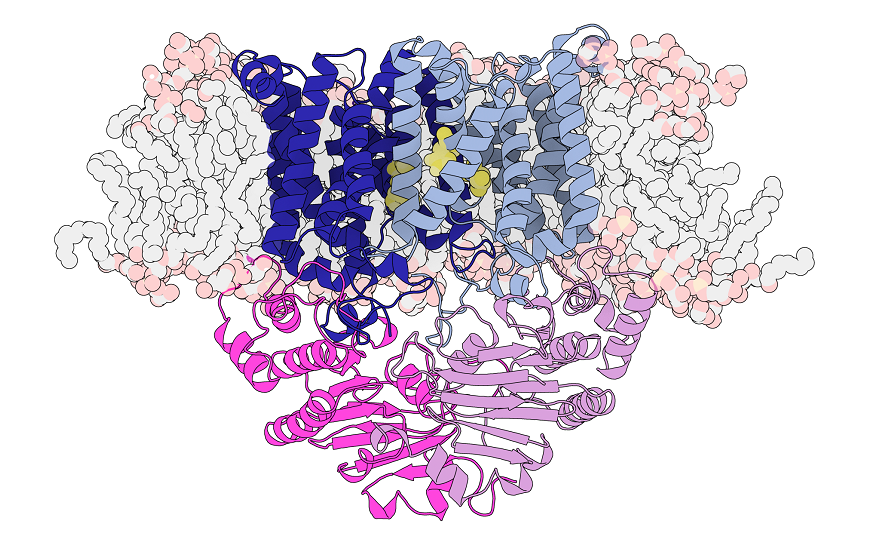
PsaBC. Голубым обозначены трансмембранные участки, серым и оранжевым — липидная мембрана, розовым — энергетический домен, желтым — упомянутые в статье аминокислотные остатки.
Hugo MacDermott-Opeskin, Megan O'Mara and Christopher McDevitt |
Пресс-релиз
Streptococcus pneumoniae — возбудитель бактериальной пневмонии, менингита, сепсиса и инфекции внутреннего уха; особенно опасен для детей. Для вирулентности, метаболизма и борьбы с окислительным стрессом бактериям нужен марганец. Ранее уже было показано, что этот элемент S. pneumoniae получает из организма хозяина. В новой работе ученые из Австралии и Японии описали строение транспортера марганца пневмококка и механизм его работы. В этом процессе участвует PsaBC — трансмембранный белковый комплекс, который относится ко второму типу ABC-пермеаз (от adenosine 5′-triphosphate-binding cassette).
Для определения структуры транспортера использовали рентгеноструктурный анализ. Самым сложным этапом было очищение PsaBC от бактериальной мембраны, этот этап исследования занял шесть лет.
Таким образом была получена структура PsaBC и найдены его отличия от других известных белков этого семейства: меньшие размеры, компактность и специальный канал, который избирательно пропускает марганец. После входа пора сужается до 0,7Å. Диаметр поры препятствует проникновению воды и более крупных элементов, а также снижает вероятность обратного выхода марганца.
Ближе к цитоплазме располагается участок канала, содержащий отрицательно-заряженные аминокислотные остатки Asp и His, которые образуют «селективный фильтр». Он обеспечивает избирательную проницаемость поры для марганца за счет образование координационных связей между переходным металлом и остатками аминокислот. С другой стороны канала располагаются цитоплазматические ворота с остатками Leu и Asp, которые участвуют в финальном этапе селективного транспорта марганца.
Результаты этого исследования можно применить для разработки новой терапии. Авторы предполагают, что нарушение работы марганцевого транспортера бактериальных клеток сработает даже на антибиотикорезистентных штаммах. Такие препараты будут безопасны для человека, так как у людей подобных транспортеров нет. Например, можно использовать то, что при мутации внеклеточного сайта канала нарушается перенос марганца в бактериальную клетку, а мутагенез селективного фильтра и вовсе останавливает транслокацию переходного металла.
Профессор Кристофер МакДевит, заведующий лаборатории в институте Доэрти, подчеркивает: «Знание структуры — это только первый шаг к разработке лекарства или терапии против S. pneumoniae. Наш подход состоит в том, чтобы заблокировать этот путь и предотвратить перенос марганца в бактерию».
Источники
Stephanie L. Neville, et al. Programmable editing of a target base in genomic DNA without double-stranded DNA cleavage. // Science Advances 7, 32 (2021), published online 06 August 2021. DOI: 10.1126/sciadv.abg3980
Цитата по
пресс-релизу


 Меню
Меню





 Все темы
Все темы




 0
0