Установлена причина высокой специфичности антибиотика фидаксомицина к клостридии
Американские исследователи изучили механизм действия фидаксомицина — антибиотика узкого спектра действия, применяемого против Clostridioides difficile. Известно, что фидаксомицин подавляет работу РНК-полимеразы C. difficile. Авторы получили структуру РНК-полимеразы в комплексе с фидаксомицином и выяснили, почему антибиотик не связывает РНК-полимеразу большинства других кишечных бактерий.
Clostridioides difficile – грамположительная кишечная бактерия, вырабатывающая токсины и вызывающая кишечные расстройства, такие как диарея, которая может закончиться летальным исходом. В 2011 году для лечения инфекций, вызываемых C. difficile, начали использовать антибиотик узкого спектра действия — фидаксомицин. Несмотря на эффективность против C. difficile, фидаксомицин безвреден для большинства кишечных бактерий. Известно, что фидаксомицин взаимодействует с РНК-полимеразой C. difficile, однако оставалось неясным, почему при этом он не вступает во взаимодействие с РНК-полимеразами других кишечных бактерий. Авторы новой работы, опубликованной в Nature, смогли ответить на этот вопрос, получив структуру РНК-полимеразы C. difficile в комплексе с фидаксомицином.
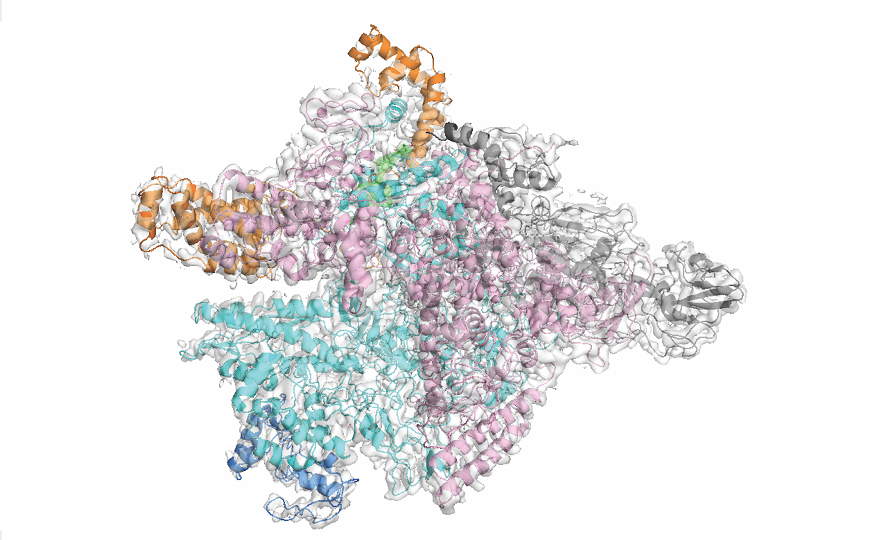
Как и у других бактерий, у C. difficile РНК-полимераза имеет субъединичный состав α2ββ’ω (кор фермента, обозначаемый буквой E) и взаимодействует с σ-факторами, направляющими ее на те или иные промоторы. Поскольку клетки C. difficile плохо поддаются культивированию, авторы исследования экспрессировали в клетках кишечной палочки Escherichia coli компоненты кора РНК-полимеразы C. difficile. Далее они выделили РНК-полимеразу C. difficile в комплексе с σ-фактором σA (EσA), необходимым для экспрессии генов домашнего хозяйства, и фидаксомицином. Структура комплекса была определена с помощью криоэлектронной микроскопии с разрешением в 3,3 Å, причем структуру некоторых участков удалось получить в разрешении от 2,7 до 3 Å.
Исследования на M. tuberculosis, чья РНК-полимераза также чувствительна к фидаксомицину, показали, что антибиотик связывается с ферментом в области «клещей» (pincers), необходимых для инициации транскрипции, и фиксирует их в открытом состоянии. Тот же механизм работает и в C. difficile, хотя положение «клещей» относительно фидаксомицина в этом случае немного иное, чем у M. tuberculosis.
Сравнение структур РНК-полимераз C. difficile и M. tuberculosis в комплексе с фидаксомицином показало, что у C. difficile важнейшую роль в связывании фидаксомицина играет остаток β’K84, который у большинства кишечных бактерий заменен на глутамат (E) или нейтральные глутамин, тирозин или серин (Q, T или S). У M. tuberculosis лизин в этом положении заменен на другую положительно заряженную аминокислоту — аргинин. β’K84 формирует солевой мостик с отрицательно заряженным кислородом в фенольной группе фидаксомицина, а также стабилизирует α-спираль в составе цинк-связывающего домена, благодаря чему остатки S85 (у M. tuberculosis заменен на аланин, A) и K86 формируют стабильные гидрофобные и водородные связи с фидаксомицином. Авторы отмечают, что в основе специфичности фидаксомицина к C. difficile лежит прежде всего положительный остаток лизина β’K84, который служит своеобразным сенсибилизирующим элементом.
Источник
Cao, X., et al. Basis of narrow-spectrum activity of fidaxomicin on Clostridioides difficile. // Nature, 2022, published: 06 April 2022 DOI: 10.1038/s41586-022-04545-z


 Меню
Меню





 Все темы
Все темы




 0
0