Возбудитель бруцеллеза в организме коровы проходит через «бутылочное горлышко»
Используя библиотеку штаммов, помеченных с помощью мобильных генетических элементов, специалисты из Университета штата Мичиган изучили структуру популяции Brucella abortus в организме теленка на раннем этапе заболевания. Оказалось, что путь от роговицы глаза до лимфоузла преодолевает лишь одна из десяти тысяч бактерий.

lurin | 123rf.com
Американские исследователи выяснили, насколько сильно снижается разнообразие возбудителя бруцеллеза при передаче к новому хозяину.
Бруцеллез крупного рогатого скота вызывает преждевременные отелы и выкидыши у коров; ущерб от него огромен. Инфекция опасна и для людей: у человека Brucella abortus вызывает тяжелое заболевание, по симптомам сходное с малярией. Болезнь излечима, но может перейти в хроническую форму и даже привести к инвалидности, особенно при отсутствии своевременной диагностики и адекватного лечения. Заражение происходит при контакте с животными или через мясные и молочные продукты, не прошедшие достаточной термической обработки. В Йеллоустонском национальном парке США более ста лет назад произошло заражение бизонов и лосей от домашнего скота; заболевание до сих пор циркулирует в популяции диких копытных, и восстановление ареала бизона искусственно сдерживают, чтобы не создать угрозы фермерским хозяйствам.
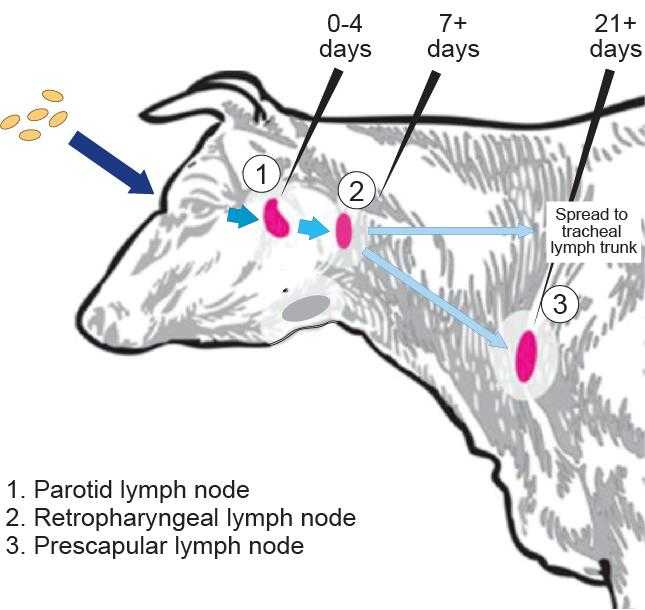 Бактерии B. abortus попадают в организм коровы (здесь — через слизистую оболочку глаза), проникают в лимфатические узлы, размножаются в них и распространяются по лимфатической системе. 1 — околоушные лимфоузлы (0–4 день), 2 — заглоточные лимфоузлы (7–21 день), 3 — предлопаточные лимфоузлы (21 день и позже; в это же время инфекция проникает в трахеальный лимфатический ствол). Aretha Fiebig | Пресс-релиз
Бактерии B. abortus попадают в организм коровы (здесь — через слизистую оболочку глаза), проникают в лимфатические узлы, размножаются в них и распространяются по лимфатической системе. 1 — околоушные лимфоузлы (0–4 день), 2 — заглоточные лимфоузлы (7–21 день), 3 — предлопаточные лимфоузлы (21 день и позже; в это же время инфекция проникает в трахеальный лимфатический ствол). Aretha Fiebig | Пресс-релиз
Изучение динамики бактериальной популяции важно не только для борьбы с болезнью, но и для понимания эволюции бруцеллы. Обычно бруцеллез исследуют на мышиной модели: далеко не у всех есть возможность проводить дорогие и сложные опыты на коровах. Но в данном случае трудности, связанные с работой на естественном хозяине патогена, полностью оправдались.
Авторы исследования получили библиотеку штаммов B. abortus, которые пометили с помощью транспозонов, содержавших уникальные последовательности ДНК (Tn-Seq — транспозонный мутагенез с NGS). «Мы, молекулярные биологи, способны обуздать “прыгающие гены”, лишив их фермента, который нужен для дальнейшего перемещения, — поясняет первый автор статьи Арета Фибиг. — Мы позволили этой ДНК запрыгнуть в геном B. abortus, но выпрыгнуть она уже не смогла».
По оценкам авторов, более 90% вставок транспозонов не влияет на инфекционность бактерий, так как лишь небольшая часть генов бруцеллы необходима ей для колонизации тканей млекопитающего.
Для эксперимента взяли шесть телят в возрасте 5–9 месяцев. Библиотека содержала 106 штаммов с уникальными штрихкодами, каждое животное получило примерно 108 бактериальных клеток, таким образом, можно надеяться, что разнообразие библиотеки было представлено полностью. Смесь штаммов наносили на конъюнктиву глаза, имитируя один из естественных путей инфицирования. (Животное также может заразиться через слизистую рта, респираторные пути или ЖКТ.)
Через неделю после заражения оценили популяцию B. abortus в лимфатических узлах животных. Чтобы оценить разнообразие бактерии, транспозонные штрихкоды амплифицировали с помощью ПЦР и секвенированали.
Ученые были готовы к тому, что разнообразие штаммов в лимфоузлах снизится по сравнению с исходным, но эффект «бутылочного горлышка» оказался неожиданно сильным. Секвенирование штрихкодов бактерий из околоушного лимфоузла и последующий расчет вероятностей показали, что колонизирует организм примерно одна из 10 000 бактерий, попавших на роговицу.
Популяции бактерий различались даже в разных лимфоузлах одного животного и состояли в основном из небольшого количества размножившихся клонов. По-видимому, самыми успешными были клоны, более обильно представленные в исходном образце. Можно сделать вывод, что в этом эксперименте иммунная система животного эффективно истребляла бактерии независимо от их генотипа.
Авторы работы надеются, что дальнейшее применение этой методики поможет определить штаммы, вызывающие тяжелое течение болезни у коров — а значит, и выявить ответственные за него гены.
Источники
Fiebig, A. et al. // Quantification of Brucella abortus population structure in a natural host. // Proceedings of the National Academy of Sciences Mar 2021,118 (11) e2023500118, published online 16 March 2021, DOI: 10.1073/pnas.2023500118
Цитата по пресс-релизу


 Меню
Меню





 Все темы
Все темы




 0
0