Флуоресцентные белки: все больше цветов, все больше задач
Только ленивый научный журналист не писал про зеленый флуоресцентный белок GFP. Он оказался потрясающим инструментом в руках исследователей: сделал невидимое видимым, позволил наблюдать за процессами в живой клетке в реальном времени. Многие знают о красном его гомологе, открытом российскими учеными. Но это только начало истории. Как с помощью флуоресцентных белков метят другие белки и клетки, сколько цветов сегодня доступно молекулярным биологам (спойлер: сотни, а хочется на три порядка больше), что общего между флуоресцентными белками и микроскопией сверхвысокого разрешения и зачем эти белки животным, которые не светятся, — спрашиваем у Константина Лукьянова.

Константин Лукьянов — член-корреспондент РАН, руководитель Отдела биофотоники и заведующий лабораторией генетически кодируемых молекулярных инструментов Института биоорганической химии РАН. Команда в ИБХ, которой руководит Константин, работает с флуоресцентными белками: открывает новые, изменяет их свойства и главное – применяет их для решения все новых научных задач. Ну и, как было некогда сказано нашим собеседником по поводу того, зачем их исследовать: «Во-первых, это красиво!»
GFP: от открытия до применения
Константин, давайте для начала уточним ключевое понятие: чем отличается флуоресценция от биолюминесценции?
Флуоресценция — это свечение под действием света. В этом случае нужен внешний источник света, ультрафиолетового или синего, который переводит молекулу в возбужденное состояние, и затем происходит эмиссия другой длины волны — зеленое свечение или красное. Есть другое обширное явление, биолюминесценция, где свечение происходит в темноте, без источника возбуждающего света, там энергия поступает из химических реакций окисления, в результате которой излучаются кванты света. Мы в основном изучаем флуоресценцию.
И то и другое встречается в природе в разных организмах?
Биолюминесценция встречается чаще, мы все знаем примеры светлячков, светящихся морских рачков, медуз и рыб. Флюоресценция в природе не так заметна. Например, она есть у кораллов — об этом знали давно, но думали, что это низкомолекулярный пигмент. Скорпионы при освещении светятся синим, иногда это используют, чтобы их ловить в темноте с фонариком. Недавно выяснилось, что даже белки-летяги могут флуоресцировать — если на них посветить ультрафиолетом, они светятся красным. А зеленый флуоресцентный белок GFP нашли в 60-х годах в медузе Aequorea victoria, его открыл японский химик Осаму Симомура. Он выделил его из медузы вместе с белком экворином, который при взаимодействии с ионами кальция светится голубым (465 нм). Выяснилось, что свечение экворина переносится на молекулу GFP, в котором есть хромофор, и он в возбужденном состоянии испускает свет в зеленом диапазоне (508 нм).
Когда ученые догадались, что GFP можно практически использовать для мечения разных клеточных структур?
GFP изучали около 30 лет, описали его химически, но никто не думал про практическое использование. В 1992 году Дуглас Прашер клонировал и секвенировал его ген, но не получил грант на дальнейшую работу и не смог показать экспрессию гена. Это один из классических примеров того, как деньги не дали на невероятно перспективное направление, которое стало прорывом в методологии и привело к Нобелевской премии. К моменту ее присуждения Дуглас Прашер ушел из науки и работал водителем такси. А экспрессию GFP показал Мартин Чалфи, в 1994 году вышла его статья в Science со светящимся червем C. elegans на обложке — GFP экспрессировался в его мотонейронах. Так было продемонстрировано, что GFP позволяет увидеть клетки — мотонейроны червя, и его можно использовать как светящуюся метку.
Через полгода или год в другой статье в Nature была показана экспрессия GFP в составе химерного белка с целевым белком. А в 1996 году получили кристаллическую структуру GFP. Оказалось, что его молекула по форме напоминает бочку, образованную бета-спиралями, внутри которых расположена альфа-спираль с хромофором.
 GFP | 123rf.com
GFP | 123rf.com
К 2008 году за открытие и изучение GFP дали Нобелевскую премию по химии, ее получили Осаму Симомура, Мартин Чалфи, а третьим был Роджер Тсиен, который подхватил и развил это направление. Он адаптировал молекулу белка к температуре теплокровных животных, сделал его цветные варианты – циановый и желтый и разработал различные сенсоры на их основе.
А каким образом он сделал из GFP варианты других цветов?
Он использовал направленный или случайный мутагенез, так можно изменять аминокислоты либо самого хромофора, либо его окружения. И тогда диапазон флуоресцентного излучения немного смещается.
С этим открытием появилась возможность мечения разными цветами?
Да, появились синий, голубой, зеленый и желтый модификации GFP. Фактически их использовали попарно: синий — зеленый, голубой — желтый, так что стало возможным двуцветное мечение. Таким образом можно изучать белок-белковое взаимодействие с помощью резонансного переноса энергии (Förster resonance energy transfer, FRET). К целевым белкам присоединяются, например, циановый и желтый флуоресцентные белки, и если между целевыми белками идет взаимодействие, мы можем его наблюдать.
«Вторая красная революция из России»
Когда ваша группа включилась в эту работу?
Это произошло в конце 90-х, но в тот момент я еще не участвовал в проекте. Руководил этой работой мой старший брат Сергей Лукьянов, в команду входил Юлий Александрович Лабас, который, исходя из эволюционных соображений, предположил, где в природе можно искать флуоресцентные белки. Идея оказалась удачной, в результате были открыты первые красные флуоресцентные белки, и это открытие в мире даже назвали «второй красной революцией из России». В общем, эта история сделала нас известными.
Вкратце она такова. GFP из медузы Aequorea victoria – единственный известный на тот момент флуоресцентный белок — встроен в биолюминесцентную систему, он работает в паре с люминесцентным белком экворином. По аналогии ученые искали новые флуоресцентные белки в таких же биолюминесцентных организмах. Идея Лабаса была в том, что биолюминесценция и флуоресценция не жестко связаны, иногда они пересекаются, иногда нет. И он предложил Сергею поискать флуоресцентные белки в коралловых полипах. Их яркая окраска была описана с 50-х годов, но они не относятся к биолюминесцентным организмам.
Сначала мы изучили коралловые полипы, которые нашли в Москве у аквариумистов, потом стали исследовать их в природе. И действительно нашли флуоресцентные белки, и команда наших генных инженеров довольно быстро клонировала их гены — Михаил Матц, Аркадий Фрадков сделали это всего за несколько месяцев. Мы обогнали людей, которые годами изучают кораллы. Можно сказать, повезло, но у нас команда очень сильная была.
 Пуговичный полип Зоантус. Видна зеленая флуоресценция на щупальцах и красная — вокруг ротового отверстия
Пуговичный полип Зоантус. Видна зеленая флуоресценция на щупальцах и красная — вокруг ротового отверстия
 Пуговичный полип Зоантус под флуоресцентным стереомикроскопом
Пуговичный полип Зоантус под флуоресцентным стереомикроскопом
Белки, которые вы нашли, можно назвать аналогами GFP? И они флуоресцируют в разных частях спектра?
Это его гомологи, они по последовательности гомологичны GFP, с которым у них 20-25% идентичности. Они относятся к тому же семейству, но у них формируется другой хромофор. Среди них есть голубые, зеленые, желтые, но самое главное, в кораллах нашлись красные белки, что очень важно с точки зрения практического использования, так как излучение в красном диапазоне лучше проникает через ткани животных.
Насколько разнообразна палитра флуоресцентных белков сегодня?
Флуоресцентные белки покрывают почти весь видимый спектр. Если налить их в пробирки, то будет как в магазине косметики: есть синие, пурпурные, малиновые, фиолетовые. Но чтобы использовать белки для совместного мечения, они должны сильно различаться по окраске.
 GFP-подобные белки в пробирках. Четыре слева — флуоресцентные, два справа — нефлуоресцентные хромобелки
GFP-подобные белки в пробирках. Четыре слева — флуоресцентные, два справа — нефлуоресцентные хромобелки
И ваша команда стала развивать способы их применения?
Да. Было несколько основных направлений применения, мы искали новые. Мы изменяли известные белки и получали новые спектральные варианты или увеличивали яркость, изменяли другие характеристики. Большой частью работы стала разработка так называемых фотоактивируемых флуоресцентных белков, когда белок не просто флуоресцирует, а под действием света меняет свойства. Например, зеленый переходит в красный, циановый переходит в зеленый и так далее, нефлуоресцентный переходит в флуоресцентный. Сейчас описано много различных вариантов, и мы к ним тоже приложили руку.
От «наблюдения под прикрытием» до сверхразрешающей микроскопии
Для исследования каких клеточных процессов используют флуоресцентные белки?
Флуоресцентные белки — это генетически кодируемая метка. Это очень удобно, так как сама клетка производит этот белок, он малотоксичный или совсем не токсичный, и не надо ничем поливать клетку снаружи, чтобы наблюдать все в динамике в живом организме. Можно, например, метить промоторы, если вам интересно проследить, где и когда включается целевой промотор гена. Вы помещаете туда GFP, и те клетки, в которых он включается, становятся зелеными, это хорошо видно.
Второе направление — это слежение за белками. У вас есть целевой белок, вы хотите увидеть, как он себя ведет в клетке. Вы присоединяете к нему GFP методами генной инженерии. Оказалось, что это хорошо работает, что большинство целевых белков терпят такие присоединения и не ломаются. И у вас получается очень мощный инструмент для того, чтобы в живой клетке увидеть паттерны распределения белка. Вы видите — где находится белок, с кем он взаимодействует, если постараться, можно увидеть, какая у него молекулярная подвижность, как долго он живет в клетке и т.д. Главное, что все это происходит в живой клетке, в реальном времени, вы можете за одной и той же клеткой следить долго. Или за одним и тем же организмом.
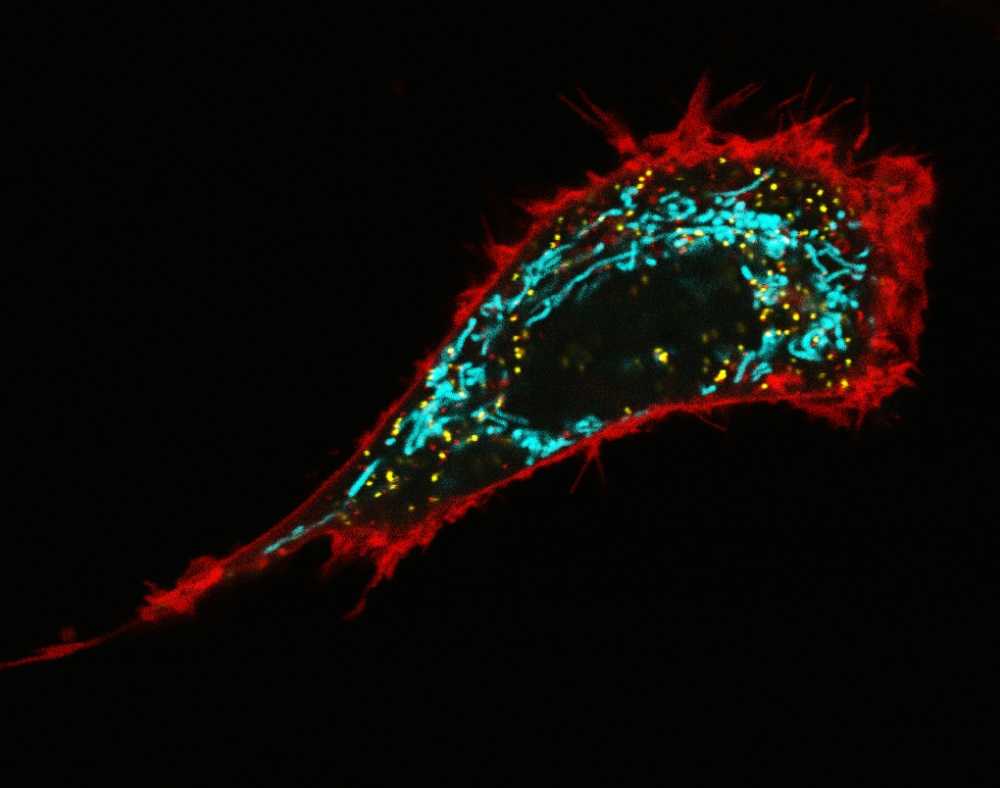 Клетка человека в культуре, экспрессирующая гены трех флуоресцентных белков. Голубой метит митохондрии, желтый — пероксисомы, красный — мембрану
Клетка человека в культуре, экспрессирующая гены трех флуоресцентных белков. Голубой метит митохондрии, желтый — пероксисомы, красный — мембрану
Третье — можно делать молекулярные сенсоры, если вас интересует не структура, а некий процесс, например, колебания концентрации ионов кальция, колебания мембранного потенциала нейронов, активация сигнальных путей, производство вторичных мессенджеров, таких как пероксид водорода и т.д. Для многих таких задач были получены флуоресцентные сенсоры, которые меняют флуоресценцию в зависимости от указанных молекул или активности. Это довольно сложная работа: требуется сочленить флуоресцентный белок с какими-то чувствительными природными доменами, которые меняют конформацию при распознавании того или иного события. Так, чтобы эти изменения передавались на флуоресцентный белок, и мы бы видели, как он меняет свою флуоресценцию, по изменению сигнала в микроскопе. Таких сенсоров сделано уже очень много, и мы их тоже делали. Уникальные сенсоры, которыми пользуются во всем мире, созданы в отделе Всеволода Белоусова в ИБХ.
Если же говорить про фотоактивируемые белки, которые мы разрабатывали, исходная идея их применения была в слежении за подвижностью белка. Вы лазером аккуратно метите конкретную область и смотрите, как оттуда распределяется белок. Пометили — там появился красный сигнал, и вы за этим сигналом следите. А затем, буквально через несколько лет, было предложено использовать это для методов флуоресцентной микроскопии сверхвысокого разрешения, за это дали Нобелевскую премию в 2014 году. В большой степени эти методы основаны на фотопереключаемых белках. Оказалось, что переключение из одного состояния в другое, иногда необратимое, иногда — в оба направления, очень удобно ложится в схемы сверхразрешающей микроскопии, позволяя с ней работать на живых клетках. При этом формально преодолевается дифракционный барьер, и разрешение становится порядка 10-20-30 нанометров вместо 200. (В «нобелевском» методе PALM (фотоактивированная локализационная микроскопия) разрешение повышается за счет раздельной по времени регистрации сигналов от разных молекул. Неодновременные сигналы как раз и подают фотоуправляемые флуоресцентные белки — они могут, например, мигать при смене режима облучения. — PCR.NEWS).
«Красный убийца» на службе у молекулярных биологов
Расскажите про белок c детективным названием KillerRed.
Это еще одно направление, которое может быть обозначено как генетически кодируемые фотосенсибилизаторы. Первый такой белок был сделан нами, это KillerRed, красный флуоресцентный белок, который проявляет высокую фототоксичность. Под фототоксичностью понимается свойство молекулы при поглощении кванта света производить активные формы кислорода. В целом флуоресцентные белки обладают крайне низкой фототоксичностью, что прекрасно — вы можете наблюдать за клеткой почти без повреждения ее. Однако есть области, где мы хотим получить высокую фототоксичность. Есть химические фотосенсибилизаторы, они даже в медицине используются, например для фотодинамической терапии рака или терапии бактериальных инфекций. Это могут быть тетрапирролы, которые в ответ на облучение светом производят вокруг себя много активных форм кислорода. Но химические вещества трудно направить в нужное место, трудно доставить в живые органы. Генетически кодируемый фотосенсибилизатор очень удачно бы дополнил эти методы. Мы сделали такой белок, фактически нашли, перебрав какое-то количество белков, просто стоящих у нас в холодильнике.
Какова природа KillerRed?
Исходно он из медузы, это неидентифицированная антомедуза, только группа известна. Из нее мы выделили хромобелок, но нефлуоресцентный. Потом мы его мутировали, чтобы получить красный флуоресцентный, получили какой-то, не очень яркий. Но он оказался очень фототоксичным. Мы проскринировали пару десятков флуоресцентных белков из очень разных групп, и оказалось, что этот белок производит примерно в 1000 раз больше активных форм кислорода, чем другие. Он довольно эффективно убивает бактерии, а в клетках млекопитающих его можно направить в ключевые чувствительные места — митохондрии, плазматическую мембрану, лизосомы, хромосомы. Он повреждает их под действием света, и это вызывает гибель клетки или остановку деления.
Наверное, такому белку можно придумать много разных применений.
Да, их довольно много. В целом это очень направленное использование окислительного стресса, локализованного в нужном месте: в отличие от фотосенсибилизаторов химического ряда, фототоксичные белки можно абсолютно прицельно направить туда, куда вы захотите. На биологических моделях это дает возможность прицельного уничтожения популяции клеток. Например, в эксперименте на животных вы можете уничтожить конкретную популяцию нейронов в мозге. Сначала вы ставите KillerRed под контроль очень специфического промотора, который экспрессируется только в заданных нейронах, затем в нужный момент эти нейроны облучаете, и они гибнут. А вы смотрите, как это влияет на поведение, на память. Такие работы были опубликованы.
А убивать раковые клетки?
Дело в том, что этот метод хорош для биологических моделей. В клинической медицине он вряд ли применим. Можно про это думать, но очень абстрактно, потому что сложно доставлять генетический материал. В данном случае я бы позиционировал его как инструмент изучения, на основе чего можно выбирать точки воздействия с помощью уже химических веществ, которые можно дать извне.
Сенсоры для эпигенетики и сто тысяч оттенков клеток
Вы упоминали, что сейчас ваша лаборатория занимается анализом эпигенетических маркеров с помощью GFP. Хотя эта работа еще не опубликована, можно в двух словах сказать про нее?
Есть такое явление — эпигенетические модификации хроматина. Происходят модификации гистонов — ацетилирование, метилирование, фосфорилирование, все вместе это составляет так называемый «гистоновый код». Он в большой степени определяет укладку хроматина, его активные и неактивные участки и, соответственно, активность генов. Теоретически, если мы знаем эпигенетическое состояние хроматина, мы можем точно сказать о состоянии данной клетки в данный момент времени. Поэтому визуализация этих маркеров очень важна. Есть методы изучения эпигенетических модификаций с помощью секвенирования, они дают замечательную информацию, но работают почти всегда с большим объемом клеток. Вам надо усреднить тысячи и тысячи клеток, и при этом теряется пространственная картина, клетки становятся неживыми, потому что из них все экстрагируют.
Мы пытаемся создать способ, чтобы «вживую» наблюдать эпигенетические модификации клетки с помощью флуоресцентных белков. Такие сенсоры уже позволяют нам отслеживать паттерны эпигенетической модификации, мы видим, где ее больше, где меньше. А если применить «компьютерное зрение» с машинным обучением, с разными алгоритмами обсчета изображений, то мы можем классифицировать клетки в зависимости от этих паттернов. И таким образом, мы надеемся, что сможем сравнивать различные состояния клеток, различные типы клеток между собой.
Что в этих сенсорах служит чувствительным элементом?
Это так называемые ридерные домены. У каждой модификации есть три основных белковых домена, которые с ней работают. Первый домен — «писатель», райтер, он приходит и вносит данную модификацию. Есть «стиратели», которые делают этот процесс обратимым, то есть все эти модификации могут быть стерты. А есть «ридеры» — читатели. Это домены, которые приходят в те места, где есть эти модификации, и связываются с ними, чтобы распознать. Обычно они входят в состав больших белков, в которых есть ридерный домен помимо других. Мы берем только ридерный домен, чтобы ничего не менять в клетке, и к нему присоединяем флуоресцентный белок. В принципе, все просто.
Какими еще «горячими» направлениями исследований занимается ваша лаборатория?
Мы пытаемся сделать очень многоцветное мечение клеток. Есть такой метод brainbow, от слов brain, «мозг» и rainbow, «радуга». Он основан на том, что клетки — в данном случае нейроны, но в принципе, любые клетки — метятся набором флуоресцентных белков, которые случайно в каждый нейрон попадают в разном количестве. Три белка. И дальше происходит то же самое, что мы видим на экранах мониторов, когда из трех цветов смешивается вся палитра. Это RGB-схема в технике, и в нашем глазу тоже есть три типа колбочек, с помощью которых мы различаем широчайшую палитру оттенков. Здесь примерно то же самое: вносятся три белка, но делается так, что стохастически каждая клетка получает немного разный набор. Где-то больше красного и меньше синего, где-то больше синего и меньше красного и зеленого, и так далее. И возникает возможность различить разные оттенки. Метод brainbow позволяет, согласно литературе, делать примерно сто оттенков, что довольно много по сравнению с тремя-четырьмя. Но все равно мало, потому что тех же нейронов — миллиарды, и сто оттенков не решают проблему. Мы пытаемся внести модификации в этот метод, чтобы видеть не сто, а сто тысяч оттенков — это компьютер будет видеть, конечно, а не глаз. И тогда мы сможем больше сказать о взаимодействиях, миграциях и прочих состояниях клеток в достаточно больших клеточных ансамблях.
Тогда каждая клетка будет своим оттенком отличаться от остальных и можно будет индивидуально ее проследить?
Вы увидите клетку и ее непосредственных потомков. Например, если это раковая опухоль, то, я надеюсь, можно будет следить за тем, как развиваются ее клоны. Если это мозг, то попытаться распутать закономерности соединения между нейронами. Если это биология развития, то проследить пути миграции этих клеток в ходе развития зародыша. Эти возможности может дать попытка увеличить количество цветов еще на два-три порядка по отношению к тому, что есть.
Зачем природе флуоресцентные белки?
Вы показали, что GFP-подобные белки — это доноры электронов, и возможно, именно в этом их первичная биологическая роль?
Про первичную биологическую роль можно долго спекулировать, но у нас нет машины времени, чтобы понять, так это было или нет. Все рассуждения о том, как зародилась жизнь, какие первичные функции были у того или другого, — можно предполагать, но подтвердить невозможно. Здесь неожиданность была в том, что мы взяли самый распространенный флуоресцентный белок GFP, который был использован в тысячах работ, и нашли свойство, которое никто не видел, показали у него процесс переноса электронов. Замечательно, что это работает не только в искусственных условиях, но и в живых клетках, на биологически значимые электронные акцепторы, это могут быть и флавины, и цитохромы, и флавинсодержащие белки. Дальше мы поняли, что это может быть основным путем фотобличинга, фотовыцветания GFP, который мешает длительному за ним слежению. И мы показали, как можно убрать этот процесс, что позволяет смотреть за GFP гораздо дольше и снять больше картинок для одной и той же клетки.
Рассуждая про первичные биологические функции, нужно исходить из того, зачем нужны флуоресцентные белки сейчас. Точно не известно, есть много идей. Где-то они работают в системе биолюминесценции, но в большинстве случаев они с ней не связаны. Показано, что в каких-то организмах они играют солнцезащитную роль, но другие организмы не нуждаются в этом и все равно их экспрессируют. Анализ эволюционного дерева показывает, что GFP и его гомологи появились очень давно. Они, с одной стороны, есть у рачков и ланцетников, а с другой стороны — у медуз и кораллов, и это означает раннее эволюционное происхождение белков этого семейства. Поэтому должна быть некая первичная функция, которая была важна для раннего организма на уровне, когда не было глаз, чтобы увидеть флуоресценцию. Солнцезащитная функция для любого организма, даже низшего, — это важно. И электронный транспорт тоже тянет на базовую функцию, потому что здесь происходит превращение энергии кванта света в транспорт электрона на такие коферменты, как ФАД c появлением восстановленного ФАДН2. Это чуть-чуть похоже на фотосинтез.
Биологическую роль GFP-подобных белков изучают единицы энтузиастов. Это не нужно с точки зрения практики, поэтому денег на это трудно найти. Это непросто, потому что те же кораллы имеют очень сложный жизненный цикл, их трудно выращивать в аквариумных условиях. Личинки кораллов экспрессируют флуоресцентные белки, никто не знает, зачем это нужно. Была интересная работа американских ученых о том, что зеленый флуоресцентный белок в одном виде медуз привлекает рыбок, и медузы их таким образом ловят. Эти ученые показали, что если нырнуть с зеленой лазерной указкой, то рыбки за ней бегают, как кошки. Видимо, некоторые медузы, а может быть, и кораллы, используют это для привлечения жертвы. Очевидно, что все этим не исчерпывается, и это точно не первичная функция, потому что тогда не было ни рыбок, ни указок. В общей сложности предложено примерно 15 разных функций, но они почти не изучаются. Очень интересно, но сложно и не нужно «широкой общественности».
«В 2000-е годы мы держались в передовых, но сейчас скорее отстаем»
Каково ваше мнение о состоянии биологической науки в России, скажем, в вашей области? С какими серьезными проблемами она сталкивается, и вообще, можно ли в России заниматься наукой?
Можно. Много людей занимается в России наукой, не только мы. Но сложно. Я думаю, что список проблем у нас примерно такой же, что и у всех. Долгая и дорогая закупка реактивов…
Все на первое место это ставят.
Ну а как без этого? Все становится дороже, раза в полтора. Большая часть крупного современного оборудования не влезает ни в какие гранты, например, у меня почти все микроскопы устарели, и я не могу их купить на грант РНФ, потому что они стоят от 30 до 100 миллионов. А нужно постоянно обновлять парк оборудования, потому что прибор еще работает, но уже морально устарел. На западе другие стандарты по технике.
В целом мало денег. Если сравнить зарплаты западных ученых и наших — мы сильно отстаем. Гранты РНФ вроде бы неплохие, но требования очень завышены. Ни один американский грант не требует восемь статей за сто тысяч долларов, уже даже меньше, чем сто тысяч. А мы обязаны опубликовать восемь статей, что абсурдно для трехлетнего проекта и приводит к тому, что мы дробим публикации. Приходится делать много маленьких статей вместо нескольких больших и хороших. Когда говоришь это на западе, все удивляются, мягко говоря. Понятно, что наше руководство хотело увеличить публикационную активность, что тоже правильно, но это немного не в то русло пошло. Бюрократии много, отчетность очень сложная: РНФ еще куда ни шло, а проекты Минобра — это просто кошмар.
Вы руководитель отдела и лаборатории. Сколько человек у вас в коллективе?
Отдел большой, а в лаборатории под 20 человек, включая студентов и аспирантов. Много молодых.
Вероятно, многие из них уедут?
Да. В 2010-е уезжали меньше, сейчас стали больше уезжать. Конечно, молодые ученые хотят ездить по миру. Это отчасти решается стажировками, когда они уезжают поработать и возвращаются.
А если сравнить уровень ваших исследований с мировым научным уровнем, что можно сказать?
Когда здесь начиналась работа с флуоресцентными белками, еще до меня, это был действительно прорыв. В 2000-е годы мы держались в передовых, но сейчас скорее отстаем. Что-то происходит нормально, есть отдельные островки, которые держатся на уровне или опережают, но в целом мы отстаем. Исследования стали другими: ты читаешь статью в ведущем журнале и понимаешь, сколько всего сделано с разных сторон, у тебя на это просто никаких ресурсов не хватит. Нужно оборудование очень высокого уровня, людские ресурсы. Очень трудно со всем этим тягаться. За счет идей еще можно, до которых там не додумались. Но идею надо реализовать, а на это нужны ресурсы.


 Меню
Меню





 Все темы
Все темы




 0
0