Фёдор Ширшиков: «Основное преимущество NEB в их системе контроля качества»
Диагностика инфекций в России развивается стремительно, но ее развитие во многом зависит от реагентов, доступных на рынке. Петлевая изотермическая амплификация — LAMP — считается перспективным конкурентом классической ПЦР. Мы узнали о тонкостях разработки и постановки LAMP-диагностики и о том, какие возможности в этой области дают реагенты New England Biolabs.
sinhyu | 123rf.com
В последнее время интерес к диагностике инфекций особенно высок. Золотым стандартом для детекции многих бактериальных и вирусных патогенов остается ПЦР, однако ученые находятся в постоянном поиске более быстрых методов и возможности их адаптации к полевым условиям. В частности, набирает популярность изотермическая амплификация. Продукция компании New England Biolabs значительно расширяет возможности на этом поле. PCR.NEWS продолжает беседовать с российскими исследователями об особенностях современных реагентов, существующих разработках и планах на будущее.
Федор Ширшиков, младший научный сотрудник лаборатории молекулярной медицины Центра молекулярной медицины и диагностики ФГБУ ФНКЦ ФХМ ФМБА России, использует метод петлевой изотермической амплификации (LAMP) для разработки диагностических тестов на бактериальные и вирусные инфекции.
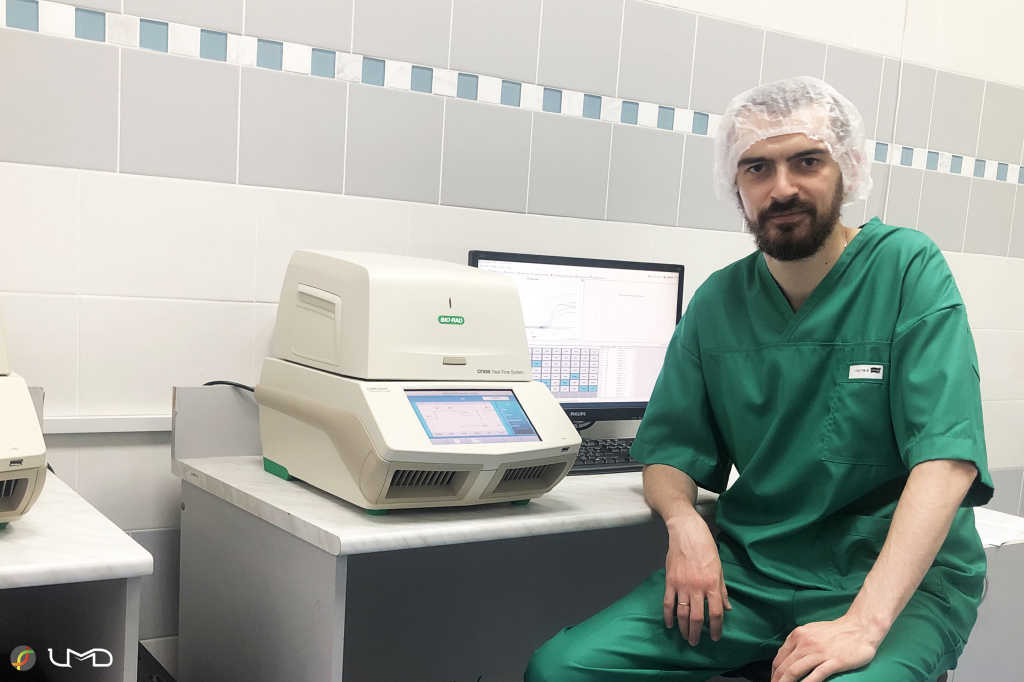 Федор Ширшиков, м.н.с. лаборатории молекулярной медицины Центра молекулярной медицины и диагностики ФГБУ ФНКЦ ФХМ ФМБА России. Credit: архив Федора Ширшикова
Федор Ширшиков, м.н.с. лаборатории молекулярной медицины Центра молекулярной медицины и диагностики ФГБУ ФНКЦ ФХМ ФМБА России. Credit: архив Федора Ширшикова
— Начинал я с разработки тест-систем для диагностики бактериальных фитопатогенов в сельском хозяйстве. Это было в Институте биоорганической химии РАН. Самый первый проект был по диагностике бактерий мокрой гнили — фитопатогенов из рода Dickeya, которые на то время были новой для России группой бактерий, поражающих картофель и некоторые другие культуры. Некоторые виды этих бактерий особо агрессивны в жарком и влажном климате. Сейчас праймеры для этой тест-системы запатентованы, и она существует в классическом лабораторном формате с детекцией в режиме реального времени, а также в формате полевой экспресс-диагностики с определением положительной реакции по цвету содержимого пробирок. Разработанная тест-система за 20 минут поднимает до 20 копий ДНК на реакцию. Тогда, в 2015 году, мы были одними из самых первых в России, кто стал использовать и изучать метод LAMP. Далее было несколько других проектов с патогенами человека и, конечно же, я успел поработать над тестами для новой коронавирусной инфекции — рассказывает Федор.
Какими реагентами вы пользуетесь?
В начале исследований мы попробовали несколько вариантов ДНК-полимераз для изотермической амплификации от разных производителей, но в итоге остановились на реагентах компании New England Biolabs. Основное преимущество NEB в их системе контроля качества. С реагентами других производителей не всегда удавалось добиться хорошей воспроизводимости результатов между разными партиями полимераз. У полимераз NEB тоже случаются небольшие флуктуации, но в целом качество намного выше. Кроме того, у NEB есть ферменты, позволяющие работать в формате «теплого старта», например, полимераза Bst 2.0 WarmStart. Они значительно упрощают работу как на этапе создания и оптимизации тест-системы, так и при дальнейшем использовании.
Чем отличается эта полимераза от обычной Bst?
Дело в том, что обычную Bst-полимеразу нельзя долго держать при комнатной температуре, например, во время раскапывания реакционной смеси. Работа со многими ферментами не на льду или без криоштатива снижает их активность, а при использовании обычной Bst-полимеразы это чревато также снижением специфичности реакции. Фермент слабоактивен даже при 25°C, и этого достаточно для получения ложноположительного сигнала. Для лабораторной диагностики это слишком большой риск. Фермент Bst 2.0 WarmStart связан с аптамером и поэтому неактивен. Мы ставим пробирки с готовой реакционной смесью в термостат или термоциклер, но только при температуре выше 45°C фермент активируется и начинается амплификация. Технология WarmStart позволяет не спеша раскапывать смесь и образцы в течение 15–20 минут (по сведениям NEB — до 2 часов!), и специфичность реакции останется высокой. За такое время можно спокойно добраться до места постановки реакции, и полимераза будет активна. Не припомню, чтобы хорошо смоделированные праймеры и оптимизированная реакционная смесь давали сомнительные или ложноположительные результаты.
Как происходит дизайн праймеров для LAMP?
У патогенов всегда есть хотя бы несколько близкородственных видов, которые трудно различить из-за высокого сходства их геномов. Обычно при дизайне праймеров ищут консервативные участки генов, размещая внутри них сайты отжига праймеров. Для LAMP критичен размер участка гена-мишени, фланкируемый праймерами. Не всегда интересующие гены содержат консервативные участки подходящей длины. Чтобы решить эту проблему, я создал новый алгоритм подбора генов-мишеней, который сейчас опубликован и существует в виде веб-сервиса MorphoCatcher. Сервисом активно пользуются исследователи по всему миру. Программа немного расширяет консервативную область гена в интересующем виде бактерии или вируса с помощью видоспецифичных нуклеотидных полиморфизмов и позволяет обработать множественные выравнивания генов из сотен различных целевых и близкородственных штаммов. Далее нужно выбрать подходящий участок, а все видоспецифичные полиморфизмы поместить на концы праймеров для усиления специфичности реакции. Все нуклеотиды, характерные для конкретного вида, будут маркированы специальными символами. Скопления таких символов можно увидеть на графике, а дальше загрузить эту маркированную последовательность в программу для дизайна праймеров. Сейчас наиболее популярны два бесплатных веб-сервиса, основанные на сходных алгоритмах. Исторически первым был PrimerExplorer — от разработчиков метода LAMP, японской компании Eiken Chemical. Он как раз и позволяет с помощью маркированной нуклеотидной последовательности поместить видоспецифичные полиморфизмы на концы праймеров или оставить их в середине олигов. Второй веб-сервис был разработан компанией NEB — LAMP Primer Design Tool. Он значительно упрощает этап разработки петлевых праймеров.
Какими еще решениями NEB вы пользовались?
Есть такой формат полевой диагностики — на основе лиофилизированных реагентов. Вся реакционная смесь здесь полностью высушена, и для запуска реакции требуется добавить жидкий образец, прошедший стадию лизиса и содержащий нуклеиновую кислоту вируса или бактерии. Для создания таких тестов удобно использовать тот же фермент Bst 2.0 WarmStart, но в более высокой концентрации. Основное его преимущество в том, что буфер с ферментом содержит меньше компонентов, мешающих полноценно высушить реакционную смесь (например, глицерина). Только с этой модификацией фермента от NEB удавалось сделать экспериментальную тест-систему, которая хранилась без холодильника — в ящике лабораторного стола — до семи дней, и потом вполне специфично работала.
Особенно хочется отметить, что у NEB есть уникальная обратная транскриптаза, или ревертаза, под названием WarmStart RTx, которая работает в том же буфере и при той же температуре, что и Bst-полимераза. С этой ревертазой можно не отделять стадию обратной транскрипции, а совместить ее с амплификацией, не меняя температуру и не добавляя дополнительное время в протокол.
В перспективе мне интересно применить в работе и другие ферменты NEB, совместимые с LAMP: фермент, повышающий специфичность реакции — Tte UvrD-хеликазу, а также урацил ДНК-гликозилазу, позволяющую предотвращать появление ложноположительных результатов даже в случае контаминации.
А с реагентами NEB для колориметрической петлевой амплификации вы работали?
Да. Этот набор удобен тем, что для постановки реакции необходимо добавить праймеры, а в качестве оборудования можно использовать обычный твердотельный термостат. Детекция амплификации происходит на основе изменения цвета pH-чувствительного красителя, поэтому результат можно оценить визуально. Состав цветного буфера NEB подходит для обнаружения коронавируса SARS-CoV-2, при этом можно отказаться от стадии выделения нуклеиновых килот и даже от предварительного термического лизиса образца. Об этом впервые сообщили в публикации немецкие исследователи. Фантастически красивая работа! Пробоподготовка всегда является лимитирующей стадией любой лабораторной диагностики, сокращает количество выдаваемых результатов, но в случае с коронавирусом после получения образца можно сразу приступать к амплификации. Компоненты буфера и высокая температура амплификации обеспечивают эффективное разрушение вирусной мембраны и РНК сразу становится доступной матрицей для начала реакции.
Над чем вы сейчас работаете?
Сейчас мы работаем над актуальным проектом по созданию тест-системы для диагностики и широкого типирования возбудителя туберкулеза. Довольно давно Всемирная организация здравоохранения одобрила первую тест-систему на основе LAMP — это был тест для диагностики туберкулеза. Он валидирован и рекомендован в качестве инструмента, дополняющего результаты микроскопии. Мы с моим научным руководителем и главой ЦММиД Юлией Андреевной Беспятых (к. б. н) хотим создать тест-систему, адаптированную для диагностики российских штаммов микобактерий. У нас есть для этого отличные условия: приборы и лаборатория, наличие ДНК штаммов возбудителя, циркулирующих на территории нашей страны, а также коллаборации с российскими пульмонологами для продолжения сбора коллекции. Сейчас наличие штаммов — важный для меня критерий перед началом создания нового теста, потому что на сбор хорошей коллекции часто уходят годы или десятилетия. Более того, для успешной трансляции метода в клинику необходима тщательная проверка специфичности. Кроме разработки конкретных тестов мне интересно развитие самой технологии LAMP, решение существующих ограничений и недостатков, дизайн новых полимераз. Метод очень перспективный. Потеснить ПЦР в диагностических лабораториях методу LAMP пока слишком трудно, но свою уникальную нишу в медицине LAMP обязательно найдет.
Партнерский материал


 Меню
Меню





 Все темы
Все темы




 0
0