Молекулярная диагностика лекарственно-устойчивого туберкулеза и микобактериозов
В честь Всемирного дня борьбы с туберкулезом мы провели вебинар о молекулярной диагностике туберкулеза и микобактериозов. Специалисты обсудили проблемы, связанные с лекарственной устойчивостью туберкулеза и ее выявлением, а также существующие тест-системы для обнаружения туберкулезной палочки и нетуберкулезных микобактерий.
NIH | flickr.com | CC BY 2.0
Двадцать шестого марта PCR.NEWS провел вебинар «Генетика и молекулярная диагностика возбудителей туберкулеза и микобактериозов». Участники обсудили текущие возможности и перспективы молекулярной диагностики туберкулеза, а также способы преодоления устойчивости микобактерий к противотуберкулезным препаратам.
Первый доклад, посвященный механизмам устойчивости микобактерий к новым противотуберкулезным препаратам, представил Данила Зименков (Институт молекулярной биологии им. В.А. Энгельгардта РАН). В докладе раскрывались результаты проекта, проведенного совместно со специалистами Московского городского научно-практического центра борьбы с туберкулезом и Новосибирского НИИ туберкулеза Минздрава РФ.
Бедаквилин — противотуберкулезный препарат нового поколения, который за рубежом начал применяться с 2012 года, а в России с 2014 года. Мишень бедаквилина — АТФ-синтаза туберкулезной палочки. Бедаквилин способен связываться с роторной частью АТФ-синтазы AtpE, в результате фермент «заклинивает». Кроме того, бедаквилин действует как разобщитель протонного градиента, так что бактерия погибает из-за истощения пула АТФ.
Однако вскоре после начала применения бедаквилина у туберкулезной микобактерии были обнаружены мутации устойчивости к препарату, и связаны они не с самой АТФ-синтазой, а с белковым комплексом MmpS5/MmpL5. Этот белковый комплекс обеспечивает эффлюкс препарата, но в норме его экспрессия достаточно низкая и регулируется транскрипционным репрессором Rv0678. Инактивация репрессора приводит к повышению экспрессии MmpS5/MmpL5, в результате снижается чувствительность к бедаквилину.
Этим же путем, через MmpS5/MmpL5, бактерии избавляются и от других препаратов, включая антимикотик эконазол, антимикобактериальный препарат клофазимин, кандидатные препараты против туберкулеза BRD-9327 (действует на эффлюксный белок EfpA), макозинон (препятствует сборке клеточной стенки), квабодепистат (также препятствует сборке клеточной стенки) и др. Таким образом, если бактерия приобретает устойчивость к бедаквилину, то этим обеспечивается кросс-резистентность и ко всем перечисленным препаратам, в том числе новым, которые только проходят разные фазы клинических испытаний.
Мутации в гене репрессора mmpR могут быть распределены по всей длине гена, что затрудняет их выявление. Наиболее часто встречаются мутации, связанные со сдвигом рамки считывания из-за проскальзывания полимеразы в участках, содержащих повторы одних и тех же нуклеотидов. В динамике лечения в пределах 90 дней лечение бедаквилином успешно, однако у части пациентов все равно детектируется туберкулезная палочка, причем чаще встречаются мутации в mmpR, хотя бывают и мутации в atpE. В экспериментах на микроэволюцию в клинических изолятах встречалось и несколько мутаций в обоих генах одновременно. Удалось также выявить мутации в аналогичной эффлюксной системе MmpS4/MmpL4. В литературе высказываются предположения, что благодаря таким мутациям могут образовываться гибриды вроде MmpS5/MmpL4, и это также позволяет бактерии «выкачивать» препарат наружу.
Следующий доклад «Гетерорезистентность M. tuberculosis в современных условиях: особенности диагностики и частота выявления» представила Софья Андреевская (Центральный НИИ туберкулеза).
Проблему гетерорезистентности патогенов называют «новым рубежом в войне с устойчивостью к антибактериальным препаратам». Гетерорезистентностью называют фенотип, при котором в клиническом изоляте сосуществуют популяции чувствительных к препарату и лекарственно устойчивых бактерий. Обычно гетерорезистентность — это промежуточное состояние между полностью чувствительной и полностью резистентной популяцией. Резистентные бактерии могут появляться в результате спонтанных мутаций, причем мутантны менее жизнеспособны и в обычных условиях оказываются в меньшинстве по сравнению с чувствительными бактериями. Однако при терапии чувствительные бактерии погибают, что позволяет устойчивым бактериям разрастись.
Спонтанные мутации у туберкулезной палочки возникают довольно редко — с частотой 10-6-10-8. Соответственно, если лечить туберкулез комбинацией из трех и более эффективных препаратов, то теоретическая вероятность возникновения лекарственной устойчивости и вовсе стремится к нулю (10-18-10-20). Однако из-за особенностей метаболизма пациента концентрация препарата в очаге может быть недостаточной, чтобы устранить спонтанно возникший резистентный клон. Возникновению гетерорезистентности также способствуют неправильно назначенная химиотерапия, низкое качество препаратов и слабая приверженность пациента лечению. Более того, большинство противотуберкулезных препаратов действуют только против пролиферирующих форм микобактерий, но неэффективны против дормантных.
Точных методов выявления гетерорезистентности на данный момент не существует. Непрямым методом обнаружения гетерорезистентности является тест фенотипической лекарственной чувствительности, при котором выделяют культуру возбудителя и определяют чувствительность этой культуры к препаратам. Однако при получении первичной культуры в этом случае преимущество получают именно чувствительные клетки, поэтому резистентные могут просто не попасть в тест. Аналогично при большом количестве резистентных клеток может быть утеряна информация о пуле чувствительных клонов.
Непосредственно клинический материал можно исследовать с помощью молекулярно-генетических методов. Для некоторых из этих методов определена дискриминирующая способность: у теста XpertMTB/RIF предел детекции (LOD) — 20–80% резистентных клеток в образце, у теста Xpert Ultra — 20–70%, у стрипов GenoTypeMTBD Rplusv2.0 — 5–10%, при этом последний в России пока недоступен. Для ПЦР в реальном времени и биочипов такие исследования не приводились. Из всех перечисленных методов только с помощью биочипов и GenoTypeMTBD Rplusv2.0 можно узнать о присутствии как бактерий дикого типа, так и мутантных бактерий, в то время как другие методы позволяют выявить только мутантов.
На данный момент, чтобы выявить гетерорезистентность, нужно обнаружить расхождение в результатах анализов, полученных одним методом в разных образцах или разными методами в одном или разных образцах, полученных от одного пациента. Чем больше анализов проводится, тем выше вероятность выявления гетерорезистентности.
Софья Андреевская представила результаты исследования, проведенного в Отделе микробиологии Центрального НИИ туберкулеза, по выявлению гетерорезистентных к рифампицину, изониазиду и фторхинолонам популяций туберкулезной микобактерии при химиотерапии.
Исследовали клинические изоляты M. tuberculosis, выделенные от больных туберкулезом, которые наблюдались в Центральном НИИ туберкулеза в 2011-2024 гг. Из более чем 5000 клинических изолятов только в 2,65% случаев наблюдалась гетерорезистентность к рифампицину и изониазиаду, которая в основном выявлялась при непрерывном наблюдении. Что интересно, в большинстве случаев гетерорезистентность удавалось выявить при исследовании операционного материала, а не мокроты. Также в основном встречалась фенотипически проявляющаяся гетерорезистентность, то есть пул резистентных и чувствительных бактерий проявлял резистентность. Именно эти данные имеют наибольшую значимость для клиницистов.
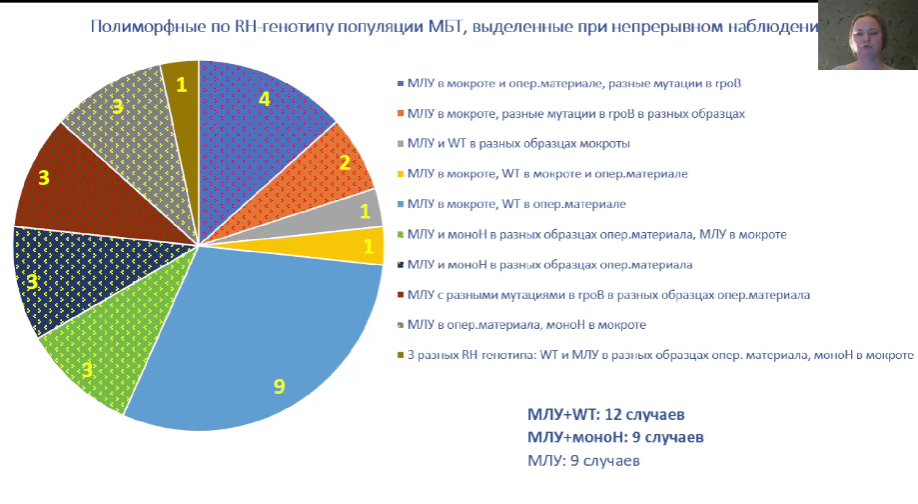
Резистентность к фторхинолонам детектировалась в трети случаев в виде мутаций в гене gyrA, причем подавляющее большинство этих мутаций были единичными. В 7% случаев встречалась гетерорезистентность к фторхинолонам, которая встречалась, как правило, у ранее леченных больных или у больных с рецидивом мультирезистентного туберкулеза. При этом более чем в половине случаев гетерорезистентности она также проявлялась фенотипически.
Об этиологической диагностике микобактериозов рассказал Вячеслав Журавлев (Санкт-Петербургский НИИ фтизиопульмунологии Минздрава РФ). Он подчеркнул, что даже при низкой заболеваемости на этапе дифференциальной диагностики должна проводиться диагностика туберкулеза, а уже затем следует выявлять возможные микобактериальные поражения. Однако специфических клинико-рентгенологических признаков микобактериоза пока нет.
На данный момент наиболее чувствительными лабораторными методами являются ПЦР (87,1%) и патоморфологические методы (100%). Разница в чувствительности объясняется именно инфекциями, вызванными другими микобактериями или родственными им микроорганизмами. Для молекулярно-генетических методов большое значение имеет качество диагностического материала, так как иногда специфическая ДНК может выявляться в низкой концентрации, и не всегда ясно, связано ли это с контаминацией образца. Операционный и (или) биопсийный материал нужно исследовать самыми информативными методами и обеспечивать как можно более быстрое прохождение через молекулярно-генетические тесты, так как исследование парафиновых блоков после патоморфологии уже будет обладать низкой чувствительностью.
Молекулярно-генетические методы могут дополнять классическую патоморфологию. В качестве примера Вячеслав Журавлев привел случай, когда после анализа биоптата патоморфологическое заключение не позволило исключить туберкулез, так как оставались очаги повреждения органов дыхания. Однако молекулярно-генетические тесты помогли снять этот диагноз, так как подтвердили инфекцию M. avium. Такие методы помогают и правильно подобрать химиотерапию.
Важно учитывать возможности имеющихся молекулярно-генетических платформ. Например, тест-система «Амплитуб-МЛУ-РВ» (Синтол) позволяет выявить 11 и 6 мутаций, вызывающих резистентность к рифампицину и изониазиду, в то время как всего таких мутаций известно 39 и 22 соответственно. Тест-система «АмплиТест МБТ-Резист-I» (АмплиТест) позволяет выявить несколько больше мутаций в тех же генах, однако ее чувствительность ниже.
Докладчик отметил, что в некоторых ситуациях наличие мутации в 100% случаев выражается фенотипически, и непонятно, зачем проверять бесспорные результаты медленными и дорогими технологиями. Даже в рекомендациях ВОЗ детекция некоторых мутаций, ассоциированных с резистентностью, позволяет назначать пациентам лекарственные препараты в высоких дозировках. Но с другой стороны, отсутствие ассоциированных с резистентностью мутаций необязательно означает фенотипическую чувствительность клинического изолята.
Еще одна проблема, важная для клинической практики, — сочетание туберкулеза и других микобактериозов. В теории оно невозможно, однако в реальности встречается. Также описаны клинические случаи, где через несколько лет после успешного окончания терапии туберкулеза у пациента вновь выявлялся процесс в легких, который ошибочно был диагностирован как рецидив туберкулеза, назначено соответствующее лечение, однако впоследствии процесс был верифицирован как микобактериоз. Такая задержка привела к резекции долей легкого. Другой пациент поступил с подозрением на рак легкого после скрининга. Диагноз сменили на туберкулез, а через 62 дня в операционном материале подтвердили инфекцию M. branderi, а не туберкулезной микобактерией.
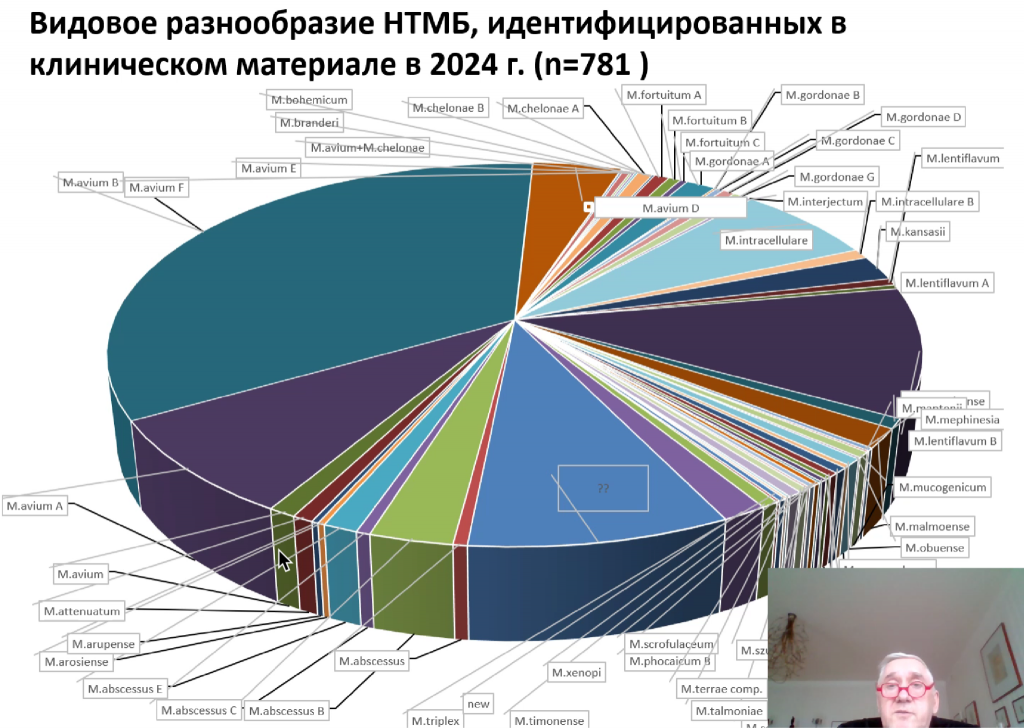
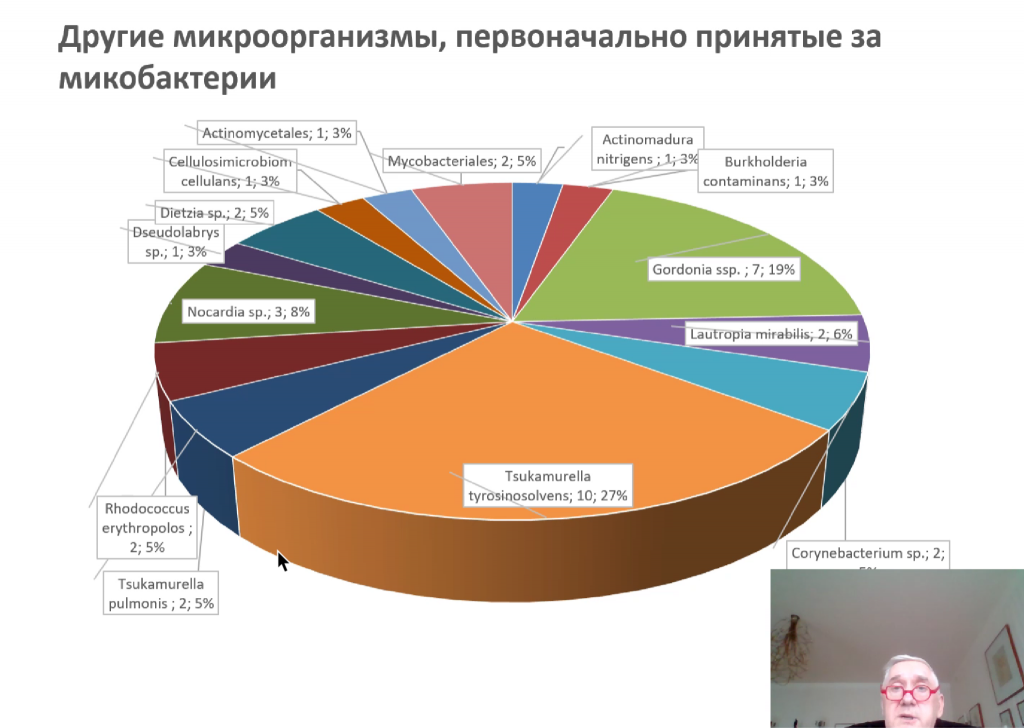
В настоящее время для клинических лабораторий доступно несколько тест-систем, выявляющих микобактериозы. К их числу относятся системы на основе ПЦР в реальном времени «МТБ-тест» (ТестГен), «Амплитуб-НТМБ — дифференциация» (Синтол), а также микобиочипы. Команда Журавлева участвовала в апробировании последней технологии и показала, что при последующем секвенировании образцов можно также выявить родственные микобактериям микроорганизмы, первоначально ошибочно принятые за микобактерии.
Соответственно, для диагностики микобактериозов оптимален следующий диагностический алгоритм: РТ-ПЦР с дифференциацией нетуберкулезных микобактерий, микочип и секвенирование. Однако в реальности для микобактериозов нет диспансерного учета, стандартов лечения, а сама патология не входит в ОМС.
Далее выступила Джессика У (Xi’an Tianlong Science and Technology Co., Ltd) с презентацией «Tianlong’s Integrated TB Solution: Redefining TB Testing with Fully Automated Speed» («Интегрированное решение компании Tianlong по борьбе с туберкулезом: Переосмысление тестирования на туберкулез со скоростью полной автоматизации»). Для общей практики компания предлагает платформу, включающую прибор для выделения нуклеиновых кислот и ПЦР-амплификатор, которая за один цикл может обработать от 32 до 64 образцов. Для специфической диагностики туберкулеза компания разработала полностью автоматизированную систему Panall 8000. Также компания представила экспресс-тесты на туберкулез TBSnapCheck, которые выявляют патоген в образцах мокроты или мазках из слизистой рта.
Прибор Panall 8000 позволяет проанализировать образцы мокроты пациента. Все этапы анализа выполняются полностью автоматически и не требуют участия специально обученного персонала. Процесс включает разжижение мокроты, выделение и очищение нуклеиновых кислот с помощью суперпарамагнитных наночастиц и запуск ПЦР. Время анализа — 120 мин, причем за один раз может быть проанализировано 8 образцов. Прибор позволяет выявить мутации устойчивости к рифампицину и изониазиду. По сравнению с другими платформами для ПЦР Panall 8000 обладает более высокой точностью и чувствительностью. Он также может быть использован для диагностики респираторных инфекций, ЗППП, гепатита, инфекций ЖКТ и ЦНС, ВИЧ.
Доклад «Генетика адаптации микобактерий туберкулеза к существующим и потенциальным противотуберкулезным соединениям in vivo и in vitro» представил Игорь Мокроусов (НИИ эпидемиологии и микробиологии им. Пастера). Сначала он рассказал об изучении 45 серийных изолятов M. tuberculosis, полученных от пациентов в процессе длительного лечения новыми антибиотиками. Проект выполнялся совместно с Калининградским туберкулезным диспансером и Санкт-Петербургским НИИ фтизиопульмонологии. Вл время лечения в штаммах от 6 из 11 пациентов появились мутации в rv0678 или в atpE, обеспечивающие устойчивость к бедаквилину. Также выявлялась гетерорезистентность. Интересно, что у штаммов тех пациентов, которые периодически прерывали лечение, появлялось сразу несколько мутаций, ассоциированных с лекарственной устойчивостью, причем устойчивость к бедаквилину возникала у разных субпопуляций штамма.
Следующий раздел доклада был посвящен исследованиям in vitro, выполненным в коллаборации с коллегами из Болгарии. Эксперименты по селекции устойчивых спонтанных мутантов, появлявшихся при культивировании в среде с активным соединением в повышенных концентрациях, выявили мутации, ассоциированные с лекарственной устойчивостью, и позволили сделать выводы о механизме действия соединения. В результате ученые смогли определить механизм устойчивости туберкулезной палочки к новым производным ароилгидразонов. Эти вещества структурно схожие с изониазидом, действуют на несколько мишеней в M. tuberculosis, мешая биосинтезу клеточной стенки, но при этом не требуют активирования, так как не являются пролекарствами.
В клонах бактерий были обнаружены мутации в различных генах, включая гены метаболических ферментов (ppgk — полифосфатглюкокиназа, glpK — глицеролкиназа), ген тРНК-метилазы SpoU, мембранного эффлюксного белка MmpS2 и гипотетического белка Rv3755c из семейства ABC-транспортеров. Интересной оказалась мутация в glpK, которая приводила к сдвигу рамки считывания и, согласно литературе, обеспечивала быстро обратимую толерантность к антибиотикам в связи со снижением скорости роста. Мутация в ppgk также вызывала сдвиг рамки считывания и тоже обеспечивала толерантность к лекарствам из-за активации более общей реакции на стресс. Таким образом, в ответ на воздействие лекарств M. tuberculosis вырабатывала разные способы защиты, на что указывает возникновение мутаций в совершенно разных путях.
В другом исследовании in vitro внимание уделялось не отдельным, а пулированным спонтанным устойчивым клонам. Это позволило оценить первичный ответ всей популяции на действие производных нитрофураниламидов. Исследователи обнаружили мутации в шести разных генах, при этом наблюдалась гетерорезистентность. Что любопытно, при более высокой концентрации препарата наблюдалась значительно бо́льшая доля мутантных аллелей. Как и в предыдущем эксперименте, мутации затронули не связанные между собой гены: rv0224c (реакция на окислительный стресс), fbiC (компонент пути биосинтеза кофактора F420, который участвует в активации нитрофуранов), iniA (эффлюксный насос, также обеспечивающий устойчивость к изониазиду), rv1592c (липаза/эстераза, эффлюксный насос, поддержание целостности мембраны). Таким образом, в этом случае появлялись неспецифические механизмы лекарственной устойчивости.
В конце доклада Игорь Мокроусов представил результаты совместного с Санкт-Петербургским НИИ фтизиопульмунологии проекта, посвященного мышиной модели экспериментального туберкулеза и химиотерапии новыми антибиотиками. В течение 200 дней после заражения мышей лечили комбинацией моксифлоксацина, линезолида, бедаквилина и перхлозона. По окончании полного курса химиотерапии значительно снизилась микобактериальная нагрузка, причем эффект терапии был наиболее очевиден у животных, инфицированных наименее вирулентными штаммами туберкулеза Beijing 6691 и LAM 7074. В ходе непрерывного и правильно подобранного курса химиотерапии мутаций, ассоциированных с лекарственной устойчивостью, выявить не удалось.
Елена Салина (ФИЦ «Фундаментальные основы биотехнологии» РАН) рассказала о проблемах диагностики и лечения латентного туберкулеза.
По оценкам ВОЗ, 25–30% населения Земли является носителями латентной инфекции туберкулеза, при этом до 80% случаев активного туберкулеза развиваются из-за активации «спящей» инфекции. Латентный туберкулез бессимптомен, и его тяжело выявить на рентгенограмме или при анализе мокроты. Доказать наличие латентной инфекции можно с помощью иммунологических тестов, в том числе кожной пробы на туберкулез (проба Манту, Диаскин тест) или анализа крови на высвобождение гамма-интерферона в ответ на антигены туберкулезных микобактерий (TB-Feron). При выявлении латентной инфекции назначают короткие схемы терапии различными препаратами.
Считается, что M. tuberculosis может переходить в «спящее» состояние в ответ на неблагоприятные физиологические условия в организме хозяина. Однако при латентной инфекции наблюдается целый спектр метаболических состояний клонов бактерии; некоторые из них могут даже развивать свойство некультивируемости. Такие клетки могут быть устойчивы к лекарствам.
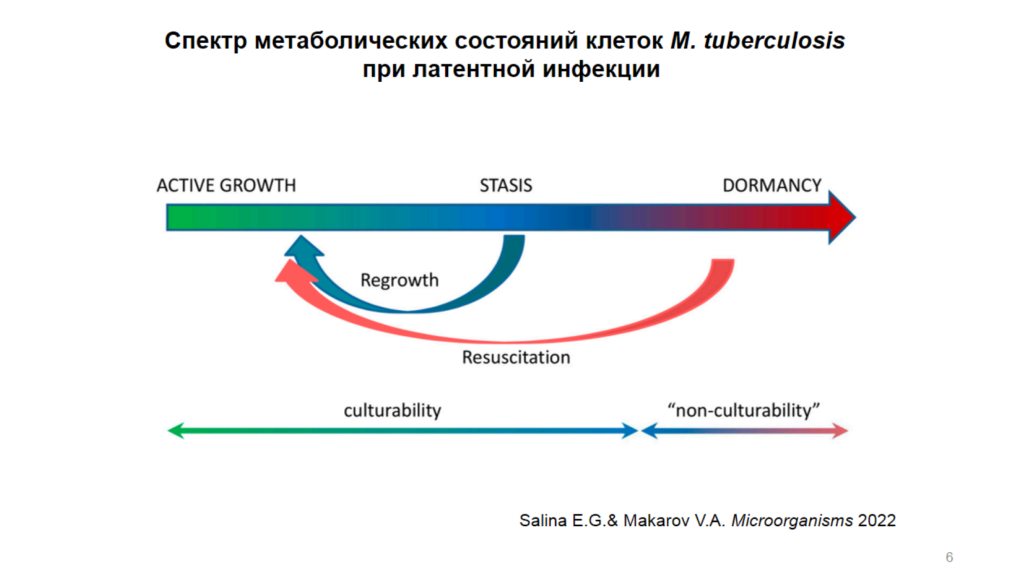
Елена Салина рассказала о разработки модели, воспроизводящая состояние некультивируемости M. tuberculosis. Так, in vitro в похожее состояние клетки переходят в условиях недостатка калия. Полученные покоящиеся клетки морфологически отличались от активных, были устойчивы к рифампицину, изониазиду, фторхинолонам, макозинону и бедоквилину, а после специальной процедуры реактивации переходили в культивируемое состояние.
Оказалось, что в покоящихся клетках снижено количество мРНК (примерно в 30–50%). Данные секвенирования РНК показали, что при этом уменьшается число транскриптов генов, кодирующих ферменты основных метаболических путей. На стабильном уровне экспрессии оставались гены белков PE-PGRS (необходимы для взаимодействия патогена с хозяином), модулей токсин-антитоксин, ферментов биосинтеза B12. Видимо, они важны для поддержания жизнеспособности покоящихся клеток или для их последующей реактивации, а потому среди них могут быть мишени для устранения латентной инфекции.
Исследователям удалось выявить некоторые препараты, которые эффективны даже против покоящихся клеток микобактерий, например, гидроксипиридинтионы. Из целого ряда производных было выбрано наиболее активное — ГПТ-2b, с низкой цитотоксичностью против клеток человека и хорошим значением минимальной ингибирующей концентрации (МИК) 50 нг/мл. При этом не удалось обнаружить спонтанных мутантов, имеющих резистентность к этому препарату. Данные секвенирования РНК указывали на то, что при обработке этим препаратом в клетке M. tuberculosis накапливаются токсичные концентрации меди, — об этом говорит изменение экспрессии транспортеров ионов металлы или оперонов, чувствительных к меди. С помощью масс-спектрометрии удалось подтвердить, что гидроксипиридинтионы образуют комплексы с медью и способствуют ее накоплению в бактериальных клетках.
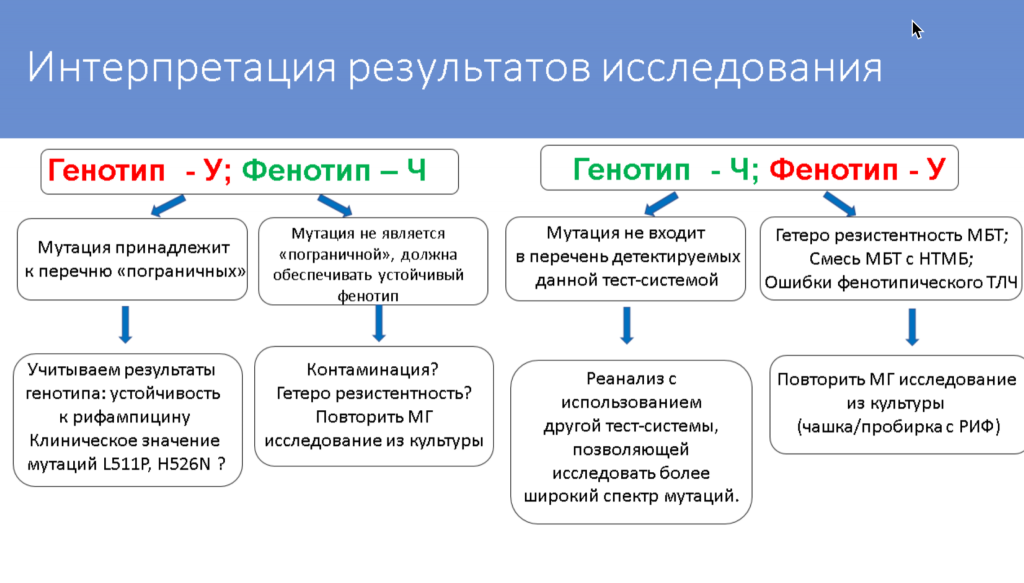
Следующей выступила Татьяна Умпелева (Уральский НИИ фтизиопульмонологии) с докладом «Тестирование чувствительности M. tuberculosis к рифампицину: в каких случаях генотип не подтверждается фенотипом?»
Режим лечения пациентов определяется в зависимости от того, резистентна ли туберкулезная палочка к рифампицину. Молекулярно-генетические методы позволяют наиболее быстро определить чувствительность к рифампицину с учетом рекомендации о том, что любая несинонимичная мутация в участке RRDR (rifampicin resistance determining region) гена rpoB означает устойчивость к этому препарату при отсутствии доказательств обратного.
Однако иногда наблюдаются расхождения между генотипом и фенотипом патогена. Так, при использовании тест-системы «ТБ-ТЕСТ» (ООО «БИОЧИП-ИМБ») встречаются случаи, когда мутации в гене rpoB детектируются, но патоген все же чувствителен к рифампицину. В случае с тест-системой «Амплитуб-МЛУ-РВ» (Синтол) одинаково часто встречается и такая ситуация, и случаи, когда бактерия резистентна, но мутации в rpoB у нее не детектируются. Однако при повторном анализе спорных образцов у 25% образцов мутации в rpoB не подтвердились, поэтому причиной расхождения генотипа и фенотипа в этом случае может быть контаминация ПЦР, отметила докладчица. Кроме того, при повторном анализе спектр мутаций в изолятах отличался. Это может быть связано с явлением гетерорезистентности.
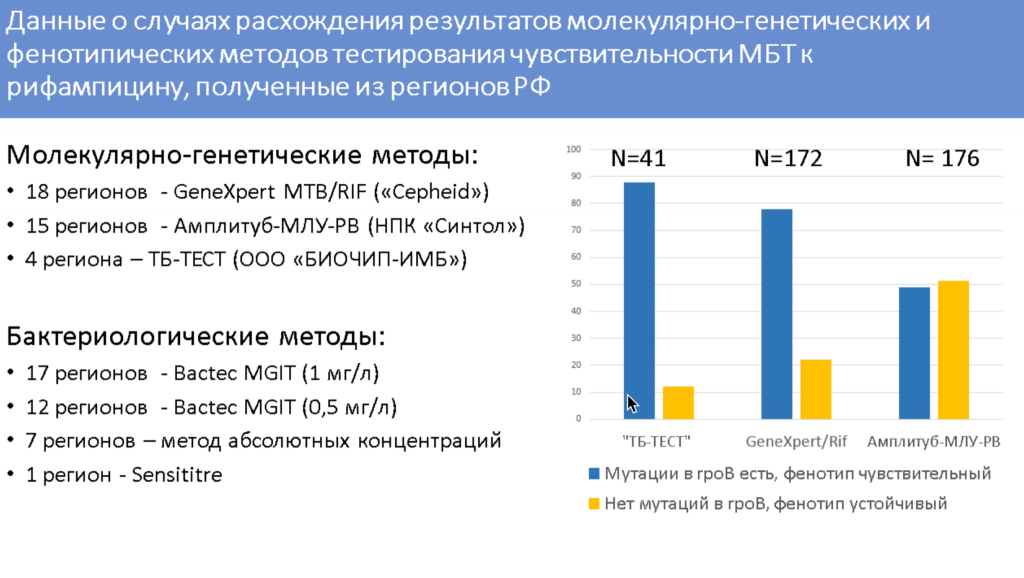
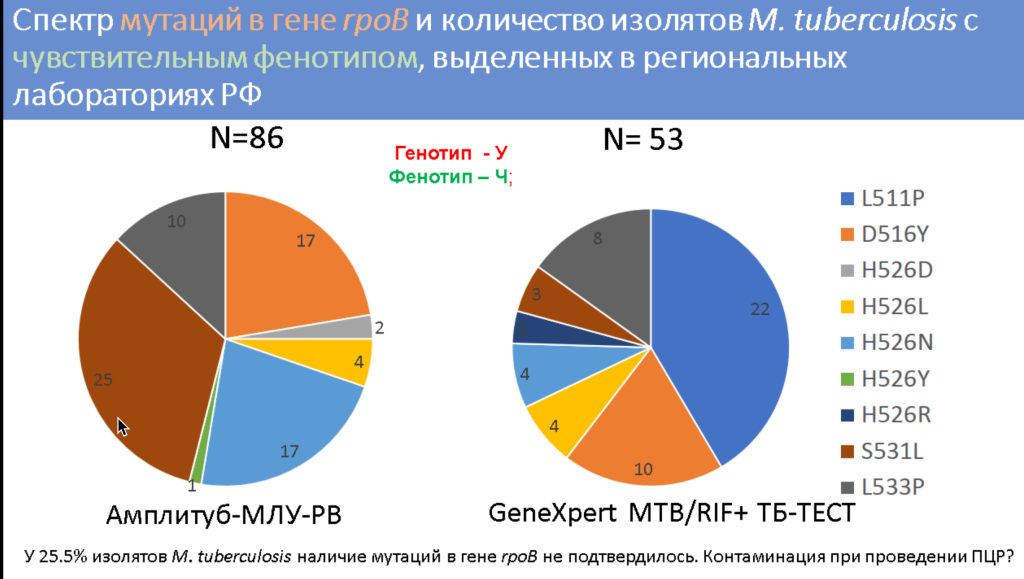
Большинство мутаций, найденных в этих изолятах, — это мутации из списка ВОЗ, вызывающие пограничный уровень резистентности к рифампицину. В таких случаях предлагается при определении фенотипической чувствительности патогена снижать критическую концентрацию рифампицина в среде до 0,5 мг/л. Однако на практике не помогло даже снижение критической концентрации до 0,25 мг/мл: все равно наблюдался чувствительный фенотип, несмотря на наличие мутации L511P. При этом в 40% изолятов не было дополнительных мутаций, которые бы обеспечивали резистентность к изониазиду, этамбутолу, фторхинолонам или аминогликазидам. В случаях же, где патоген имел дополнительные мутации в rpoB (как в RRDR, так и вне RRDR), значение МИК увеличивалось, а фенотип был устойчивым.
Вместе с тем возникает вопрос, нужно ли считать, что у мутации L511P есть клиническое значение в отсутствие дополнительных мутаций в rpoB. В литературе описан случай успешного лечения туберкулеза с таким генотипом по схеме, включавшей помимо других препаратов рифампицин в повышенной дозировке.
Другая найденная мутация, при которой расходились генотип и фенотип, — H526N. Уменьшение критической концентрации рифампицина в среде также давало результаты, говорящие о чувствительном фенотипе. При этом у всех клинических изолятов с данной мутацией были выявлены мутации и к другим противотуберкулезным препаратам. У шести изолятов с мутацией H526N также встречалась дополнительная мутация I491M, которая способствует резистентности и детектируется тест-системой «АмплиТест МБТ-Резист-1» (ФГБУ «ЦСП» ФМБА).
При повторном анализе изолятов, в которых не детектировались никакие мутации, но фенотип при этом был резистентным, у 46% изолятов также не было обнаружено мутаций (и у половины из этих изолятов фенотипическая устойчивость тоже не подтвердилась), а у остальных они все-таки были детектированы.
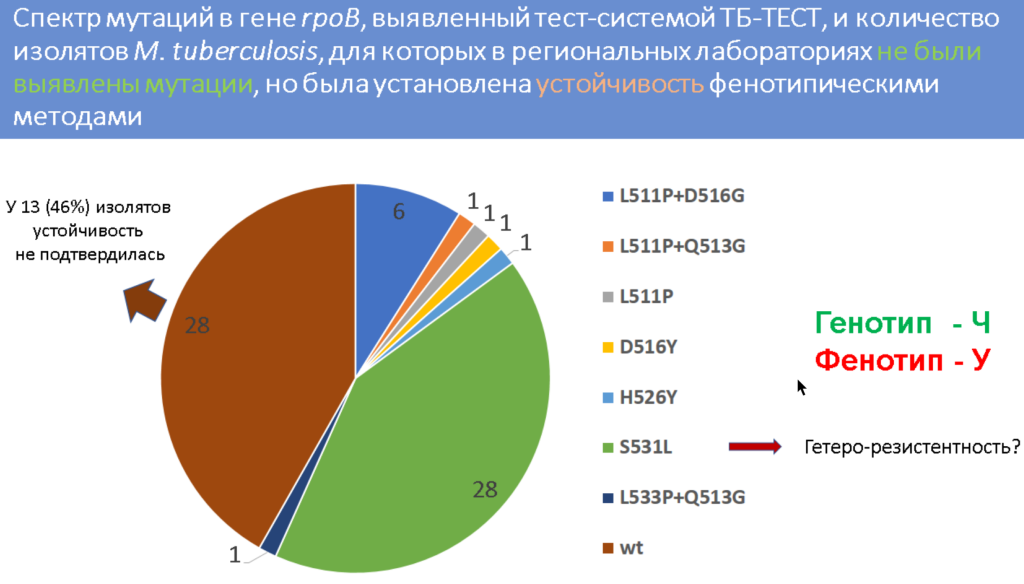
Исследователи отметили, что причиной несоответствия может быть гетерорезистентность, которая не детектируется имеющимися тест-системами. Согласно инструкции «Амплитуб-МЛУ-РВ» нужно считать, что в образце нет мутаций, если разница между пороговым циклом для канала, в котором детектируется ген rpoB, и пороговыми циклами для каналов, в которых определяются мутации, превышает 7. Однако эксперимент, в котором в разных соотношениях смешивали патогены дикого типа и мутантов, показал, что при малом количестве мутантной ДНК (90% дикий тип, 10% мутант) разница между пороговыми циклами больше 7. В такой ситуации может быть сделан ошибочный вывод об отсутствии мутаций.
На основе проведенных исследований ученые представили алгоритм интерпретации результатов, при которых наблюдается расхождение между генотипом и фенотипом.
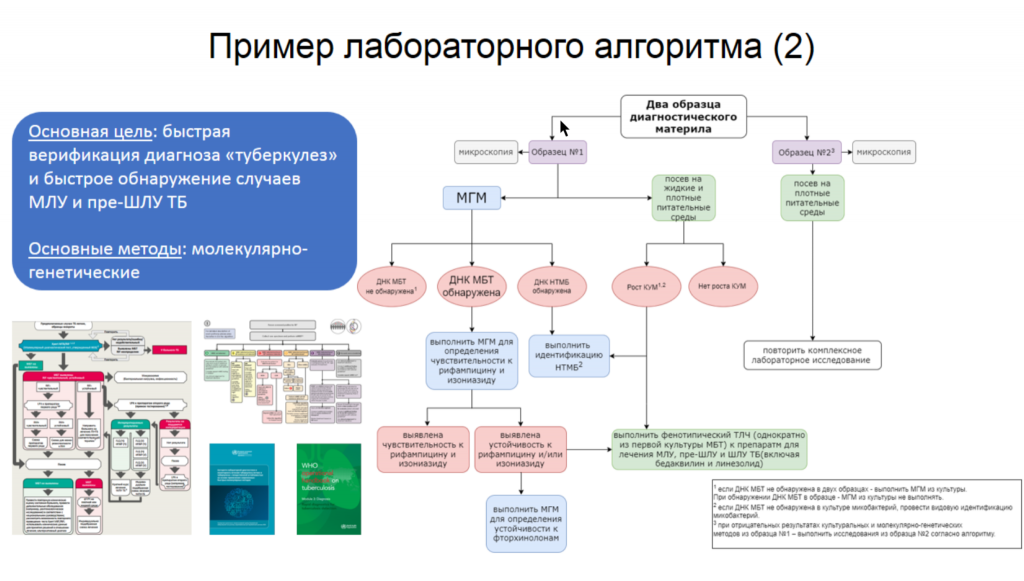
Платон Елисеев (ФГБУ «НМИЦ ФПИ» МЗ РФ) выступил с докладом «Основные аспекты диагностики туберкулеза согласно российским и международным рекомендациям».
По данным Референс-центра на 2023 год, в России 94,3% лабораторий охвачены молекулярно-генетическими методами, 97,9% — тестами на лекарственную чувствительность. В РФ действуют клинические рекомендации «Туберкулез у взрослых» от 2024 года, согласно которым в диагностике туберкулеза должен использоваться комплексный подход, сочетающий микроскопические, бактериологические и молекулярно-генетические методы, где последним отдается приоритет. Платон Елисеев представил пример алгоритма исследования диагностического материала.
Помимо клинических рекомендаций, существует ряд нормативных актов, которые особенно актуальны для лабораторий, планирующих проводить диагностику микобактериальных инфекций. В этих нормативных актах приведены требования к персоналу и оснащению лабораторий, в которых осуществляется диагностика.
В России выпускаются различные тест-системы и оборудование, в том числе ПЦР-амплификаторы. Однако некоторые технологии не производятся в России: например, приборы для автоматизированной детекции роста микобактерий в жидкой среде, тест-системы для картриджной ПЦР, NGS-системы для таргетного секвенирования и тест-системы на основе изотермической амплификации. Разработки таких систем только ведутся.
Вебинар завершил доклад «Молекулярно-генетическая диагностика микобактериозов» Юлии Аляпкиной (Синтол). Для выявления нетуберкулезных микобактерий комбинируются традиционные микробиологические и молекулярно-генетические методы. Однако микробиологические методы неспецифичны, так как не дают возможности дифференцировать туберкулезных микобактерий от нетуберкулезных и идентифицировать патоген до вида. Видовая идентификация в культуре может быть проведена с помощью масс-спектрометрии, но этот метод не может использоваться для диагностиики. В свою очередь, ПЦР-РВ, биочипы и секенирование отличаются высокой специфичностью и чувствительностью. Кроме того, эти методы позволяют исследовать непосредственно диагностический материал, в том числе сразу определяя лекарственную устойчивость за счет выявления мутаций.
На данный момент зарегистрированы уже две тест-системы на основе ПЦР от «Синтол» и «ТестГен» для выявления и идентификации нетуберкулезных микобактерий. Еще один набор от «Синтол» находится на стадии регистрации, как и микобиочип.
Набор для идентификации нетуберкулезных микобактерий от «ТестГен» представляет собой отдельные компоненты в жидкой форме в пробирках и рассчитан на 96 реакций. Чувствительность тест-системы — 102 ГЭ/мл для канала детекции нетуберкулезных микобактерий и 103 ГЭ/мл для канала детекции всех микобактерий. Однако тест-система не позволяет дифференцировать коинфекции нетуберкулезными и туберкулезными микобактериями.
Набор для дифференциальной диагностики нетуберкулезных микобактерий «Амплитуб-НТМБ-дифференциация» от «Синтол» поставляется в предраскапанном виде, адаптирован под планшетные амплификаторы и рассчитан на 48 образцов. С помощью тест-системы можно выявить 12 видов нетуберкулезных бактерий. Чувствительность системы — 500 ГЭ/мл. Также система позволяет дифференцировать коинфекции. Клинические испытания набора проводились в ФГБНУ «ЦНИИТ», в рамках которых было проанализировано 282 образца клинического материала, 40 модельных образцов клинического материала, 290 культур и 16 отдельных образцов смесей ДНК микобактерий, наиболее часто встречающихся в клинической практике.
Информация о докладчиках
Зименков Данила Вадимович, к.б.н., ведущий научный сотрудник лаборатории технологий молекулярной диагностики, Центр высокоточного геномного редактирования и генетических технологий для биомедицины, Институт молекулярной биологии им. В.А. Энгельгардта Российской академии наук (ИМБ РАН), (Москва)
Андреевская Софья Николаевна, к. м. н., в.н.с., руководитель лаборатории микробиома отдела микробиологии ФГБНУ «ЦНИИТ» (Москва)
Журавлев Вячеслав Юрьевич, к. м. н., руководитель направления «Лабораторная диагностика», Санкт-Петербургский НИИ фтизиопульмунологии Минздрава России (Санкт-Петербург)
Dr. Jessica Wu (Джессика У), Xi’an Tianlong Science and Technology Co., Ltd, China
Мокроусов Игорь Владиславович, д.б.н. заведующий лабораторией молекулярной эпидемиологии и эволюционной генетики, НИИ эпидемиологии и микробиологии им. Пастера (Санкт-Петербург)
Салина Елена Геннадьевна, д.б.н., руководитель группы биохимии адаптации микроорганизмов Федеральный исследовательский центр «Фундаментальные основы биотехнологии» Российской академии наук (Москва)
Умпелева Татьяна Валерьевна, к. б. н., ведущий научный сотрудник отдела микробиологии и доклинических исследований Уральского научно-исследовательского института фтизиопульмонологии — филиал ФГБУ «НМИЦ ФПИ» МЗ РФ России
Елисеев Платон Иванович, к.м.н., ведущий научный сотрудник, заведующий научной лабораторией микробиологии ФГБУ «НМИЦ ФПИ» МЗ РФ России
Аляпкина Юлия Сергеевна, к.б.н., руководитель департамента разработки и внедрения ПЦР-наборов ООО «НПФ СИНТОЛ»


 Меню
Меню





 Все темы
Все темы



 0
0





