О вирусах и людях
Вадим Израилевич Агол не нуждается в представлении: патриарх отечественной биологической науки, выдающийся вирусолог и молекулярный биолог. Несмотря на свой солидный возраст (12 марта ему исполнилось 93 года), Вадим Израилевич продолжает работать, но, ссылаясь на проблемы с памятью, устные интервью не дает. Для нас было сделано исключение — Вадим Израилевич счел возможным поделиться своими воспоминаниями, наблюдениями и мыслями, которые сегодня невероятно актуальны. С удовольствием их публикуем.

Беседа состоялась до 24 февраля 2022 года
«Что в науке правильно, а что неправильно, решал чиновничий аппарат»
Вадим Израилевич, хотелось бы начать с вашего детства. Все знают о трагической судьбе Николая Ивановича Вавилова и разгроме генетики в СССР, но мало кто знает о том, что в числе расстрелянных вместе с Вавиловым генетиков был и ваш отец, выдающийся советский ученый Израиль Иосифович Агол. Какие остались воспоминания о тех временах?
Да, отец был крупным генетиком, философом и организатором науки. Он, в частности, соавтор классической работы, выполненной под руководством А.С. Серебровского, в которой было впервые показано, что ген делим и состоит из более мелких единиц. Эта знаменитая статья опубликована в год моего рождения.
Вскоре родители развелись, и отец переехал на Украину — сначала в Харьков, а потом в Киев, где он до ареста в 1936 году заведовал отделом в Зоологическом институте Украинской академии наук, был избран академиком этой академии и стал ее ученым секретарем, а также заведовал — правда, очень недолго — кафедрой генетики Киевского университета. И у него, и у матери появились новые семьи. Я остался с мамой.
Почему же решили идти в том же направлении, что и отец? Он всё же оказывал на вас влияние?
Пятилетним ребенком отец забрал меня в Киев, где я прожил с ним, кажется, не меньше года. Он действительно хотел меня как-то приобщать к науке. В своей детской комнате я пересеивал дрозофил из одной пробирки с агаром в другую и разглядывал их под микроскопом. Однако вскоре произошло событие, которое намного сильнее сказалось на моем менталитете.
Играючи, я развинтил составной ремень отца, использовавшийся для правки опасной бритвы, и он распался на составные части. Отец спросил: «Кто развинтил ремень?» Я сказал, что не знаю. Последовала порка. Конечно, не за ремень, а за вранье. Она крепко зафиксировалась в мозгу на всю жизнь. Хотя с точки зрения современной «новой морали» такая процедура — явный криминал, но, думаю, ее испытывать в сходных ситуациях было бы полезно всем, кто вступает на научную (и не только) стезю.
 С отцом. Киев, 1935
С отцом. Киев, 1935
Как дальше складывалась ваша судьба?
Школьником каких-нибудь научных интересов я не проявлял. В старших классах — драмкружок, стихосложение… И по окончании школы поступить пытался в театральные училища и в литературный вуз. Но, несмотря на некоторые успехи, двери этих заведений для меня не открылись.
Чтоб куда-то деть аттестат зрелости, отнес его в находящийся недалеко от дома мединститут. И там на первых двух курсах — самодеятельность и стихи. Но в конце второго курса прочитал только что переведенную на русский язык книгу Альберта Сент-Дьёрдьи «О мышечной деятельности», которая меня заинтересовала настолько, что я решил подключиться к изучению этой проблемы.
Одним из лекторов, которые нам читали тогда лекции, был профессор кафедры биохимии Илья Ильич Иванов. Он как раз изучал механизм мышечного сокращения. Я пришел к нему и сказал, что хочу начать работать под его руководством.
Он спросил, знаю ли я английский. Получив отрицательный ответ, пригласил снова зайти, когда это препятствие исчезнет. В начале следующего семестра я сказал ему, что уже могу читать английские научные тексты со словарем, и он согласился меня принять.
Моя первая научная статья была опубликована в соавторстве только с Ильей Ильичом в «Докладах АН СССР» уже через два года, а к концу учебы был собран материал для кандидатской диссертации.
Тем не менее, несмотря на информацию об этом, содержавшуюся в характеристике, подписанной заведующим кафедрой Героем Социалистического Труда Борисом Ильичом Збарским (вскоре арестованным, а потом реабилитированным), я был распределен врачом в Красноярский край. Ведь у меня было два немаловажных греха: об одном вы упомянули — сын «врага народа», а второй — еврей (по тогдашней официальной терминологии — «безродный космополит»).
Но вы как-то преодолели эти трудности?
Приложив очень значительные усилия, я смог изменить место назначения на Карагандинский мединститут (Караганда тогда была одним из центров ГУЛАГа) и после смерти Сталина смог защитить в Москве кандидатскую диссертацию, целиком основанную на студенческих экспериментах.
Правда, тоже не без серьезных происшествий. Хотя командировка в Москву для защиты была согласована с дирекцией института, я был уволен «за прогул». Смог (тоже с приключениями) восстановиться по суду, но уехать из Караганды удалось лишь в 1956 году, после ратификации Советским Союзом в 1955 году конвенции ООН о запрещении рабского труда. До этого уволиться с работы без согласия администрации учреждения было невозможно.
В Москве, несмотря на серьезную поддержку с разных сторон, найти работу было крайне трудно (из-за моих упомянутых грехов). Но судьбоносное решение принял наш выдающийся вирусолог Михаил Петрович Чумаков, директор совсем недавно основанного им Института по изучению полиомиелита, зачисливший меня младшим научным сотрудником в лабораторию биохимии. Проработал я в этом Институте, менявшем свое название, 65 лет.
Знаю, изучением вирусов вы занялись не сразу…
Да, вирусами заинтересовался только через несколько лет после поступления туда, а сначала занимался изучением углеводного обмена в тканевых клеточных культурах, на которых вирусы размножаются. Этот мой извилистый, никак заранее не планировавшийся маршрут в вирусологии более подробно описан в повествовании, опубликованном в 2011 году. Кстати, в этой же книге перепечатана и автобиографическая повесть отца, изданная незадолго до ареста под символическим названием «Хочу жить».
Что думаете сейчас о фигуре Лысенко и всем том, что случилось с генетикой в СССР? Считаете ли, что впоследствии удалось преодолеть тот научный провал, который образовался в нашей стране?
Здесь два аспекта. Что касается биологической науки как таковой, то сколько-нибудь заметных (по крайней мере, мне) следов нет. Но у тех событий была и другая важная грань — что в науке правильно, а что неправильно, решал могущественный чиновничий аппарат. И не только решал, но и проводил эти решения в жизнь жестким административным путем. Вот этот след, увы, не изжит и проявляется при разных обстоятельствах.
У фундаментальной науки нет и в принципе не может быть географических границ. Опасения об «угрозе потери научного суверенитета России», высказанные профессором одного из правительственных образовательных учреждений на недавней международной конференции, выглядят, мягко говоря, анекдотически. Но, к большому сожалению, это не единственный пример такого мышления.
«Неужели вы верите, что РНК-рекомбинация существует?»
Среди ваших научных работ есть «фундаментальные», посвященные эволюции и филогении вирусов, и «практически значимые», например, об эволюции вируса полиомиелита — это жизненно важный вопрос. Расскажите о связи того и другого.
Вопрос о смысле и значении фундаментальной и прикладной наук — действительно, крайне важен. Всякая классификация (а это разделение наук — пример классификации) требует точного определения терминов. Эти определения — результат договоренности, то есть субъективны и условны. По Википедии, «Фундаментальные научные исследования — это (…) исследование предмета с целью получения новых основополагающих знаний, (…) результаты которых не предполагаются для непосредственного практического использования. Прикладные научные исследования — это (…) исследования, которые используют достижения фундаментальной науки для решения практических задач».
Вроде бы просто и ясно, но на практике эти термины понимаются отнюдь не однозначно. И, например, при оценке фундаментальных достижений часто требуют учитывать их прикладное значение.
Другое дело, когда речь идет об ученых. У них задача — понять, как устроена природа, и (или) сделать что-то новое. И между этими вариантами нередко границы нет. Ставится задача сделать какой-то новый практический продукт, но для этого приходится выяснять, как что-то устроено вокруг нас. Или решается фундаментальный вопрос, но сначала нужно сделать какое-то практическое новшество, или же найденное решение, наоборот, позволяет какое-то новшество создать.
Любое новшество (теоретическое или практическое) основывается на знании об устройстве внешнего мира. Это знание — фундамент, на котором стоит наука. Этот фундамент и есть фундаментальная наука, basic science. Без фундаментальной науки не было бы прикладной, а без прикладной не было бы цивилизации (и фундаментальной науки, в частности).
Грубейшая ошибка — недооценивать фундаментальную науку, презрительно обзывать ее «наукой для науки». Но недооценивать прикладную — тоже крайне глупо.
Лично для меня первичной является попытка описать и (или) объяснить что-то неизвестное в каком-то достаточно общем явлении. Но, разумеется, я с удовольствием использую возможность, если таковая возникает, указать, как это новое знание может быть использовано в практической деятельности.
Сейчас счет коронавирусных геномов идет на миллионы, но и до пандемии секвенирование вирусов стало практически научной рутиной — «большие данные», омиксные науки... Вы начинали совсем в другое время, когда секвенирование было сложным и дорогим экспериментом. В вашей статье «В погоне за интригующими головоломками» говорится, что «секвенирование больших сегментов РНК тогда было нам недоступно». Как вирусологи работали, если нельзя было сказать «а давайте отсеквенируем и посмотрим»?
До 80-х годов прошлого века для разделения и идентификации/характеристики белков и нуклеиновых кислот, а также их фрагментов, мы в основном использовали пять методов: электрофорез в полиакриламидном геле, хроматографию на разных носителях, фракционирование молекул и молекулярных комплексов по их плотности или массе путем ультрацентрифугирования, гибридизацию нуклеиновых кислот и электронную микроскопию. Так, для выявления различий между молекулами РНК применяли олигонуклеотидное картирование: препараты РНК гидролизовали нуклеазами до мелких олигонуклеотидных фрагментов, которые затем подвергали двумерному электрофорезу.
Чтобы получить некоторое представление о распределении в геноме вируса участков, различающихся по набору нуклеотидов, использовали денатурационное картирование: проводили частичное плавление репликативных (двуспиральных) форм генома РНК-содержащего вируса, фиксировали эти молекулы в таком состоянии и изучали локализацию расплавленных участков под электронным микроскопом. Участки, обогащенные адениловыми и уридиловыми нуклеотидами плавились легче участков, богатых гуаниловыми и цитидиловыми нуклеотидами.
Электронную микроскопию использовали и для сравнения геномов относительно близкородственных вирусов – отжигали (+)-РНК одного партнера с (-)-РНК другого и под электронным микроскопом изучали распределение неспаренных участков в двуспиральной молекуле.
Для оценки синтеза макромолекул определяли включение в них радиоактивных предшественников.
Сейчас некоторые из этих подходов выглядят забавно, даже анекдотически. Но тогда они позволяли нам получать новую и важную информацию.
Расскажите об этом на примере вирусной рекомбинации. Фермент вируса, который копирует вирусный геном, РНК-зависимая РНК-полимераза, перескакивает с одной матрицы на другую, и получается гибридный продукт, голова от одного вируса, хвост от другого. Как вы в 80-е годы установили, что такие вещи происходят?
Первые публикации о возможности рекомбинации между геномами РНК-вирусов появились в начале 60-х годов прошлого века. Клетки заражали двумя близкородственными, но фенотипически различающимися вирусами, и об образовании рекомбинантов судили по появлению потомков, проявляющих признаки обоих «родителей».
Однако этот факт можно было объяснить также не обменом фрагментами РНК-геномов между партнерами, а просто возникновением соответствующих мутаций. Ведь такие мутации, приводящие к изменению фенотипа, вполне могли происходить и при размножении индивидуальных вариантов вируса. Именно такой, альтернативной интерпретации придерживались многие.
Когда я начал изучать эту проблему, наш институт посетил выдающийся американский вирусолог Джозеф Мелник. И он спросил меня с удивлением: «Неужели вы верите, что РНК-рекомбинация существует?» Да, я верил. И нам удалось получить первые прямые, биохимические доказательства ее существования.
Как вы уже отметили, секвенировать протяженные сегменты РНК мы тогда не умели. Поэтому мы сравнивали белки, кодируемые предполагаемым рекомбинантом, с белками, синтезируемыми каждым из двух партнеров смешанной инфекции.
Серьезная трудность заключалась в том, что тогда изучать рекомбинацию можно было только между близкородственными партнерами, а большинство пар гомологичных белков родственных вирусов очень схожи и практически неразличимы обычными методами. Но все же проблема оказалась решаемой, поскольку фрагменты этих белков, получаемые при частичном ферментативном расщеплении, несколько различались по структуре и размеру. И эту разницу можно было обнаружить при их электрофоретическом анализе. При помощи такого анализа мы показали, что структурные белки исследуемый нами предполагаемый рекомбинант унаследовал от одного «родителя», а неструктурные — от другого.
Но вопрос о механизме обмена фрагментами РНК-геномов оставался открытым. Подступиться к его решению мы смогли через несколько лет, когда научились секвенировать достаточно протяженные участки РНК.
Оказалось, что между сегментами рекомбинантных геномов, унаследованных от разных «родителей», имеются небольшие участки, общие как для рекомбинанта, так и для его обоих предшественников. Причем эти участки располагались в местах, в которых родительские геномы потенциально были способны образовать вторичную структуру.
На этом основании была предложена следующая модель. Сначала геномы одновременно реплицирующихся вирусов-партнеров образуют локальную гетеродуплексную структуру. Вирусная РНК-полимераза, синтезирующая комплементарную цепочку на матрице одного из партнеров, делает вместе с этой цепочкой очень короткий «прыжок» на близлежащий гомологичный участок молекулы-партнера.
При этом точность посадки, важная для сохранения жизнеспособности рекомбинанта, задается именно гомологией между 5'-концевой последовательностью строящейся («прыгающей») цепи и участком «приземления» (мы писали — anchoring, то есть «заякоривания») на посадочной площадке. Эта модель предполагает неравномерное, но предсказуемое (и в действительности наблюдаемое) распределение точек перекреста по длине генома. По существу, это была модель репликативной рекомбинации по механизму смены матрицы.
Через некоторое время в прямых опытах мы доказали существование и другого механизма рекомбинации между РНК-геномами, при котором ковалентное соединение двух фрагментов РНК происходит без участия вирусных белков.
«Вакцинацию против полиомиелита в обозримом будущем прекращать нельзя»
Предлагаю перейти к практике и поговорить об исследованиях молекулярной эпидемиологии и эволюции полиовируса. Ваше исследование вакциноассоциированного паралитического полиомиелита, одно из первых, статья 1987 года про Белоруссию, — что там была за вакцина? Вакцинный штамм может как мутировать, так и рекомбинировать со штаммами дикого типа?
В работе, опубликованной в 1987 году, мы исследовали набор изолятов полиовируса, выделенных от больных полиомиелитом в Белоруссии в 1967-1985 годах. Использовали уже упомянутое олигонуклеотидное картирование. Оказалось, что значительное число изолятов — слега измененные варианты вакцинного вируса типа 2, что подтверждало начавшие незадолго до этого появляться данные о возможности производных живой оральной противополиомиелитной вакцины (ОПВ, вакцины Сэбина, содержащей смесь выведенных им аттенуированных вариантов трех серотипов полиовируса) вызывать параличи.
Но раз уж вы спрашиваете о Белоруссии и молекулярной эпидемиологии, то значительно более важной была работа, выполненная совместно с соавтором и предыдущей статьи Эсфирью Фельдман из Минска и двумя группами американских вирусологов — Константина Чумакова и Олена Кью — и опубликованная в 2003 году.
В Белоруссии ОПВ весьма успешно использовалась с 1959 года. Вакцинировано было более 90% детишек. Чтобы выяснить длительность иммунитета, был проведен эксперимент (не нами) — с марта 1963 года по март 1966-го в Могилеве и Могилевской области прекратили вакцинацию.
Правда, в марте 1965 года 40 ребятишек из шести детдомов все же получили по дозе ОПВ. В Минске обследовали сыворотки, полученные в 1965-66 гг. от невакцинированных детей в возрасте от года до трех, то есть родившихся не менее чем через год после прекращения вакцинации и, следовательно, не имеющих материнских антител. Дети были из разных детдомов (но только не из тех, где вакцина ограничено все же использовалась).
Результаты свидетельствовали о широкой циркуляции полиовируса. Но на это указывали не только антитела. В мае-октябре 1965 г. из случайной выборки 392 здоровых воспитанников разных детдомов (опять не тех, где проводилась ограниченная вакцинация) было изолировано несколько образцов полиовируса типа 2.
Для исследования современными (тогда) методами нам были доступны четыре вируса. Не буду останавливаться на деталях, а приведу перевод заключительного раздела выводов этой статьи, в заглавие которой включены следующие слова «Возможный сценарий на будущее»: «… В этой (т.е. – Могилевской) области в течение данного периода имели место распространенная циркуляция и эволюция независимых линий производных ОПВ. Судя по всему, некоторые из них произошли от 40 детей, получивших ОПВ в период остановки вакцинации. Эти данные показывают высокие риски, связанные как с локальным прекращением использования ОПВ, так и с предлагаемым применением ОПВ для предупреждения новой циркуляции полиовируса после прекращения вакцинации. Показанная здесь высокая контагиозность ОПВ в неиммунной популяции и известное существование людей, длительно выделяющих ОПВ, должны приниматься во внимание и при оценке рисков синхронного глобального прекращения использования ОПВ». К очень большому сожалению, эти риски не были учтены Всемирной организацией здравоохранения (ВОЗ), и предположенный нами сценарий полностью реализовался.
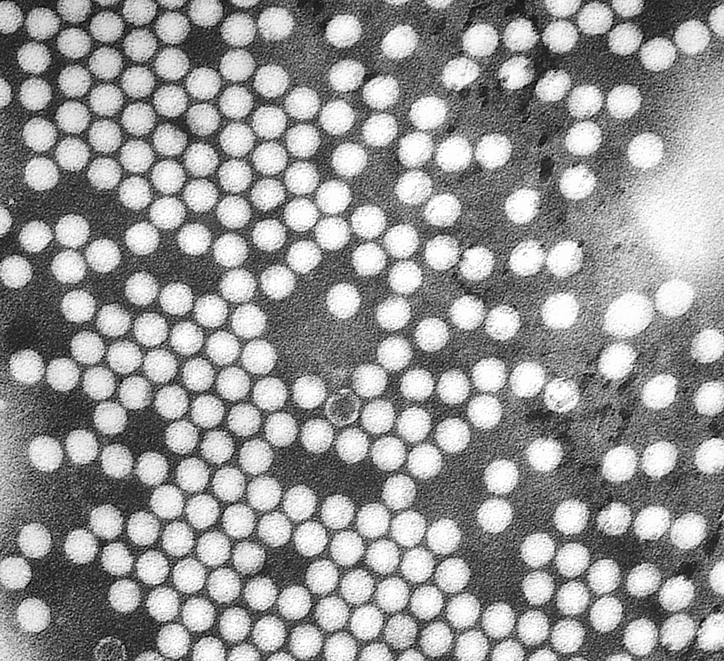 Вирус полиомиелита | Wikipedia.org
Вирус полиомиелита | Wikipedia.org
Почему вакцинный вирус передается от человека к человеку и эволюционирует в популяции, как обычный вирус? От чего вообще зависит болезнетворность вируса и как можно ее уменьшать?
Вакцинный вирус с точки зрения вирусологии — вполне обычный, полноценный вирус. Ведь болезнетворность — это отнюдь не обязательное качество облигатного паразита. Более того, вирусу выгоднее быть неболезнетворным. Зачем приносить вред организму, в котором комфортно жить и размножаться? Наиболее «умные» вирусы совершенно безвредны. Конечно, среди этих паразитов есть «малообразованные», которые еще не научились жить мирно, и их размножение может сопровождаться различными нарушениями нормального обмена веществ в организме хозяина.
Но есть еще очень важная причина, которая может делать вирус болезнетворным. Это выработанное эволюцией умение организма бороться с вирусами, а точнее — с чужеродной генетической информацией в виде ДНК или РНК. При этом защитные, оборонительные системы организма воюют с любыми чужаками, не умея различать миролюбивых и болезнетворных гостей. Это очень важные элементы врожденного, неспецифического иммунитета. Причем среди этих оборонительных средств есть как относительно безопасные, так и саморазрушительные. К последним, в частности, относятся разные системы программируемой смерти клетки. Таких, как апоптоз, некроптоз и некоторые другие.
Логика очень простая — чтобы не заболеть (а тем паче не умереть), надо убить клетки, в которых собирается жить и размножаться иностранец. Но тут уже и вирусу приходится приспосабливаться и организовывать службу собственной безопасности. Для этого он обзаводится специальным вооружением. Например, некоторые нужные вирусу белки приобретают дополнительные противозащитные свойства. Но часто вирусы прибегают к инновациям — вырабатывают или приобретают разнообразные белки, которые им бы не понадобились для размножения, если бы клетки не оказывали самоубийственного сопротивления. Мы назвали такие белки «секьюрити-белками» и посвятили им ряд работ. Они могут вызывать различные патологические процессы в заражаемых клетках.
Здесь следует сказать, что у животных есть и особое вооружение, направленное непосредственно против вирусов, которое обычно самому организму вреда не приносит. Это специфический, адаптивный (то есть приобретенный) иммунитет. Он вырабатывается только на тот вирус, с которым организм уже успел познакомиться. Тут тоже есть разные механизмы, но один из самых важных — это гуморальный ответ, образование антител. Антитела узнают вирус по его «одежке», белковой оболочке, в которую упрятан геном. Присоединяясь к этой оболочке, антитела не дают вирусу «раздеться».
Таким образом, производимое вирусологами превращение обычного или, как говорят, дикого вируса в аттенуированный (вакцинный) заключается в первую очередь (но не только) в удалении его противозащитного вооружения при полном или частичном сохранении способности размножаться в зараженном организме. Хорошо, если также удается приглушить какие-то качества, возбуждающие самоубийственную активность неспецифического иммунитета или приводящие к нарушению обменных процессов. Но тут ситуация непростая, и в данном разговоре нет возможности обсуждать ее достаточно подробно.
Однако аттенуированный вирус остается вирусом, а у вирусов, особенно у РНК-содержащих, есть неотъемлемое свойство — изменчивость, вызываемая как мутациями, так и рекомбинацией. И эта изменчивость может проявляться в том числе в приобретении или усилении патогенной активности. Поэтому один из важных подходов к созданию безопасных живых вакцин — снижение возможностей для изменчивости. И такие подходы действительно существуют.
Вот эти разные закономерности принимаются в расчет при конструировании более безопасных производных вакцинных штаммов Сэбина.
Вы участвовали в расшифровке вспышки полиомиелита в Таджикистане 2010 года, которая захватила и соседние страны, в том числе Россию. Это был уже не вакцинный, а дикий вирус? Как исследовали филогенетические деревья вирусов — тогда уже были современные инструменты?
Да, эту вспышку мы, имея уже адекватное методическое оснащение для определения первичной структуры РНК-геномов, исследовали довольно подробно. Вспышка была вызвана «диким» штаммом полиовируса 1-го серотипа. Оказалась она весьма значительной — не менее пяти сотен заболевших в Таджикистане (а оттуда инфекция была экспортирована еще в Казахстан, Россию, Туркменистан и Узбекистан).
Началось все, судя по построенному филогенетическому дереву, с завоза вируса из Индии в конце 2009 года. Важнейшим фактором, вызвавшем широкую циркуляцию этого пришельца, был явно недостаточный уровень профилактической вакцинации. Об этом говорило отсутствие антител к полиовирусам 2-го и 3-го серотипов у значительной доли обследованных детишек, родившихся за несколько лет до вспышки (напомню, что ОПВ ведь содержит все три серотипа).
Мы охарактеризовали также существенную эволюцию, произошедшую в потомстве этого иммигранта-одиночки, в том числе появление его рекомбинантов с другими энтеровирусами.
Практический же вывод из анализа этой ситуации был очень простой, известный, но тем не менее крайне актуальный: необходима постоянная массовая вакцинация, которую, по крайней мере, в зонах риска следует контролировать серологическими обследованиями, чтобы не ориентироваться только на официальные данные, которые могут быть (и в Таджикистане, по-видимому, были) сфальсифицированы.
Так что нам делать с полиомиелитом? Прекращать вакцинирование, конечно, нельзя, потому что дикий вирус никуда не делся, но живую оральную вакцину можно заменить убитой? Или использовать менее опасные штаммы?
Это очень важная проблема. И относительно подхода к ее решению, к сожалению, нет консенсуса. Что касается официальной позиции ВОЗ, то в 1988 году она была сформулирована очень жестко. После глобального искоренения (eradication) полиомиелита, которое должно было быть достигнуто к 2000 году, вакцинацию против этой болезни нужно будет прекратить, а имеющиеся где-либо образцы вируса — уничтожить.
К намеченному сроку цель достигнуть не удалось, и финиш откладывался и откладывался. Мы же вместе с моими друзьями, видными американскими вирусологами — Экардом Виммером, Константином Чумаковым и Элли Эренфельд — настаивали (в публикациях в авторитетных журналах), что вакцинацию в обозримом будущем прекращать нельзя. По крайней мере, по двум причинам.
Во-первых, невозможно быть уверенным в том, что в природе нигде не осталось притаившегося полиовируса, а во-вторых, потому что синтезировать этот вирус в лаборатории можно быстро, легко, без особых знаний и затрат. Поэтому он может выпрыгнуть на свет либо по случайной неосторожности, либо умышленно — в качестве биологического оружия.
Другое серьезное решение ВОЗ, принятое в 2016 году — исключение полиовируса типа 2 из трехвалентной вакцины Сэбина, а вместо этого включение в график вакцинации убитой трехвалентной вакцины Солка. Обосновано это было наблюдавшимися заболеваниями, вызванными производными серотипа 2 ОПВ.
Мы, та же компания, в принципе против замены живых вакцинных вирусов на убитые. Ведь вакцина Солка, хотя безопасна и эффективно защищает от заболевания, но, в отличие от ОПВ, не индуцирует иммунитет в кишечнике и поэтому не предотвращает трансмиссию вируса. При неизбежном существовании значительных невакцинированных (или недовакцинированных) популяций отсутствие в живой вакцине какого-то серотипа может, наоборот, приводить к реализации описанного выше сценария. Действительно, заболеваемость, вызванная производными вакцинного полиовируса типа 2, после этого решения ВОЗ резко возросла.
Поэтому надо усовершенствовать вакцину так, чтобы она, вызывая полноценный иммунитет, была бы максимально лишена возможности производить болезнетворное потомство. Тем более что это, как я уже говорил, вполне реализуемо, и ВОЗ уже выдала разрешение на применение одной такой новой вакцины.
И еще наша четверка возражает против явно избыточных требований к организации безопасных условий для лабораторных работ с полиовирусом. Эти меры уже привели к серьезному сокращению соответствующих крайне важных фундаментальных и прикладных исследований.
 Карантинное уведомление Департамента здравоохранения США о заражении помещения полиомиелитом. Сан-Франциско, около 1910 г. И век спустя проблема все еще не решена
Карантинное уведомление Департамента здравоохранения США о заражении помещения полиомиелитом. Сан-Франциско, около 1910 г. И век спустя проблема все еще не решена
Все возможные вирусы
Давайте коснемся систематики и филогении вирусов. Можно ли рассказать понятно для невирусологов путь длиной почти в полвека — от вашей статьи 1974 года, где описываются все теоретически возможные вирусы, все возможные варианты их молекулярного устройства — до вашей совместной статьи с Евгением Куниным и Мартом Круповичем в прошлом году?
Понятный, как надеюсь, и сильно упрощенный ответ потребует все же довольно много места. Да, работа над статьей «О системе вирусов», опубликованной в 1974 году в журнале «Успехи современной биологии» (этот журнал был основан моим отцом в 1932 году, и он был его первым ответственным редактором) — важный эпизод в моей жизни.
Дело в том, что за три года до этого выдающийся американский ученый Дэвид Балтимор опубликовал статью, в которой предложил классифицировать все известные в то время вирусы по характеру их геномов: двуспиральная (+/-)ДНК, односпиральная (+)ДНК, двуспиральная (+/-)РНК, односпиральная (-)РНК и два класса с односпиральным (+)РНК-геномом, в одном из которых репликация осуществляется при участии промежуточной (-)РНК, а в другом — промежуточных (-)ДНК и (+/-)ДНК. (Отмечу, что именно за открытие механизма обратной транскрипции, реализуемого у вирусов, которые теперь поэтому называют ретровирусами, Балтимор получил Нобелевскую премию.) При этом знаком (+) он впервые предложил обозначать цепи РНК, которые при трансляции способны образовывать белки, а знаком (-) — комплементарные им. И такими же знаками обозначил соответствующие им цепи ДНК.
Сейчас все это кажется очень естественно и просто, но тогда это был настоящий прорыв, подчеркивающий разнообразие вирусных генетических систем — ведь все клеточные организмы имеют (+/-)ДНК-геномы и попадают в одну общую группу.
В отличие от Балтимора, в статье 1974 года я попытался рассмотреть генетические системы не только известных вирусов, но все теоретически возможные их варианты. Возможными считал те, которые основаны на принципе комплементарности нуклеиновых кислот. Кроме того, обсуждаемые системы переноса генетической информации включали не только путь от генома до (+)РНК, но также и необходимость воспроизведения (то есть репликации) самого генома. При этом рассматривались наиболее простые, не содержащие повторяющихся звеньев цепочки реакций.
Теоретически в природе могут существовать восемь видов геномов или генетических единиц: четыре односпиральных – (+)РНК, (-)РНК, (+)ДНК, (-)ДНК и четыре двуспиральных – (+/-)РНК, (+/-)ДНК, (+)РНК/(-)ДНК, (-)РНК/(+)ДНК. Я перечислил 44 типа реакций, названных актами синтеза, которые могли бы приводить к образованию этого набора путем последовательных актов синтеза односпиральных или двуспиральных генетических единиц на односпиральных или двуспиральных матрицах. Так, на матрице (+)РНК могут синтезироваться (-)РНК, (-)ДНК, (+/-)РНК и (+)РНК/(-)ДНК. Пояснять же все варианты здесь нет возможности и, надеюсь, необходимости.
Были сконструированы цепочки реакций, которые могли бы обеспечить репликацию (увеличение числа копий генома) и экспрессию (синтез белков) генетических единиц. Цепочки, в которых одна из генетических единиц рассматривалась как родительский геном, были названы путями передачи информации.
Оказалось, что можно такие пути сгруппировать в иерархическую систему, состоящую из 35 классов (она воспроизведенa в нашей недавней статье, упомянутой вами). Изученные к 1974 году вирусы попадали лишь в восемь из них.
Сразу же встали и обсуждались два важных вопроса: можно ли предположить существование вирусов с необнаруженными в то время путями передачи информации, а если некоторые варианты этих путей запрещены или, по крайней мере, сильно затруднены, то чем это обусловлено? Например, ыло высказано предположение о возможном предстоящем открытии вирусов, принадлежащих по крайней мере к еще четырем классам.
В частности, обсуждалась вероятность существования ДНК-содержащих вирусов, у которых репликация генома включала бы механизмы обратной транскрипции, т.е. синтеза ДНК на матрице РНК. Вскоре такие вирусы были, действительно открыты. Наиболее известный из них – вирус гепатита В.
Полвека назад мне было очень интересно обдумывать эти общебиологические проблемы. И не только мне. Насколько знаю, эта моя статья повлияла на желание, в частности, студента биофака МГУ Жени Кунина выбрать кафедру вирусологии для своей специализации.
Вместе с тем надо признать, что вообще-то эта работа, хотя она была опубликована и на английском, прошла практически незамеченной. Но недавно Женя (ныне — один из мировых лидеров в области эволюционной биологии) решил ее оживить, и в нашем обзоре ей был посвящен отдельный раздел. К восьми ранее обжитым клеточкам постулированной системы (из 35 там присутствующих) присоединились еще шесть. В них поселились ныне открытые вирусы (или плазмиды). Обсуждаем мы также возможные причины запретов или нереализованности значительно большего числа теоретически мыслимых генетических систем.
Вышесказанное касается лишь одного из разделов этой новой статьи. А там рассматривается и ряд других важных и интересных проблем.
«Поддержка фундаментальной науки у нас недопустимо слаба и во многом некомпетентна»
Нельзя не спросить про коронавирус. Прямо сейчас происходит эволюция вируса, патогенного для человека, изучение этой эволюции приобрело беспрецедентные масштабы. Это изменило эпидемиологию, это изменило разработку вакцин. А как это повлияет на вирусологию, на фундаментальную науку о жизни?
Признаться, я уже не в состоянии детально следить за работами о коронавирусах. Если кликнуть «covid» в популярной базе биомедицинской литературы PubMed, то выскочит более 230 тысяч ссылок. Это демонстрирует несомненно возросший интерес к вирусологии и понимание (хотелось бы думать — не только сиюминутное) ее важности. Открыто множество ранее неизвестных фактов, разработаны эффективные вакцины, что, конечно — замечательно!
Но мне кажется (может, ошибаюсь), что тут все-таки есть и некоторый перекос в использовании человеческих и материальных ресурсов. Никаких значительных прорывов в фундаментальной науке о жизни, насколько понимаю, все-таки не произошло. В основе всей этой массы публикаций лежат ранее сформулированные принципы. Да и новые вакцины сооружены на уже существовавшем фундаменте. Может быть, использование хотя бы небольшой части затраченных ресурсов просто на расширение этого фундамента принесло бы человечеству больше пользы.
У вас огромное количество учеников. Уже среди наших спикеров, с кем мы успели поговорить, учителем вас называют как минимум трое, Евгений Кунин, Петр и Константин Чумаковы. С огромным пиететом говорят о вас все. Сотни или даже тысячи нынешних молекулярных биологов и вирусологов прослушали ваш курс лекций о вирусах, который стал легендарным. Что для вас учительство? Кого вы считаете своими учителями?
Конечно, мне доставляет огромную радость и удовлетворение достижения учеников. Вообще, к преподаванию я относился с самоотдачей, затрачивая на него уйму времени. Недавно была виртуальная встреча выпускников кафедры вирусологии МГУ, проживающих в США, на которой я сказал, что воспринимаю тех ее выпускников, кому преподавал, как родственников. А тех, с кем до сих пор поддерживаю связь, как близких родственников.
Что касается прямых учителей, то, назову двоих. Это уже упомянутый Илья Ильич Иванов. Основные уроки, которые я от него получил — это серьезное, я бы сказал, чистоплотное отношение к науке, необходимость строгого обоснования выводов, а также внимательного восприятие критики, но и отстаивания своей точки зрения. А второй — великий математик Израиль Моисеевич Гельфанд, биологический семинар которого я посещал свыше тридцати лет. Там он нас учил и воспитывал, демонстрируя яркие примеры глубокого проникновения в самую суть изучаемой проблемы и оценки действительной значимости этой проблемы для науки. Воспоминания (в том числе мои) об этом уникальном семинаре есть в открытом доступе.
А в молекулярной биологии, вирусологии и генетике приходилось полагаться на самообразование.
В прошлом веке генетика была отброшена назад из-за лысенковщины, потом грянули девяностые, сейчас — новые проблемы… Как вы оцениваете нынешний уровень отечественной генетики и молекулярной биологии? Есть ли шанс «догнать и перегнать» развитые страны?
Не возьмусь давать оценку теперешнего уровня этих разделов нашей науки. Просто уже не в состоянии достаточно детально следить за их развитием. Но из прессы можно узнать, что у нас, несмотря на очень серьезное недофинансирование науки (судя по ее доле в ВВП) по сравнению с передовыми странами, постоянно растет число научных и образовательных учреждений «мирового уровня». Причем получают они это почетное звание, еще не начиная работать!
Но тем не менее ясно вижу, что те из моих учеников, которые эмигрировали за рубеж, там достигли неизмеримо более ярких и значимых результатов, чем те, кто остался в стране. Должно же этому быть научное объяснение. По моему оценочному (как теперь рекомендуется говорить) суждению, это, несомненно, связано с тем, что поддержка фундаментальной науки у нас недопустимо слаба и во многом некомпетентна.
Вадим Израилевич, хотелось бы коснуться и вашего литературного поэтического творчества. Что оно для вас значит? Это что-то не пересекающееся с научной деятельностью или взаимосвязанное? Помогает ли вам это в науке?
У поэзии (и вообще у искусства) есть нечто общее с наукой — это попытка описать и объяснить внешний мир, живой и неживой. Но есть и существенное различие. Если наука основана на универсальных строгих законах логики и стремится к объективности (то есть независимости от особенностей менталитета ученого), то в поэзии, наоборот, весьма ценятся образность (а не строгая логика) и субъективизм. В ней не может быть единых правил.
Мои интересы в науке сфокусированы на молекулярной биологии, генетике и эволюции, а в стихах — на людях (и себе, в частности), на их поведении и психологии, а также на общественном устройстве. Поэтому эти два интереса не пересекаются и не противоречат друг другу. И если что-то интересное иногда (к сожалению, не очень часто) удается сформулировать в одной области мозга, то другая не завидует и не ревнует. Разве что могут конкурировать за время. Наука у меня — занятие преимущественно дневное, а стихосложение – ночное.
Стихи, как известно, часто рождаются в результате озарения, инсайта. А научные идеи, открытия? Есть ли тут что-то общее? Насколько для вас важна интуиция в науке и в жизни?
Конечно, она важна. Эту гостью, если вдруг неожиданно посещает, встречаю, разумеется, с удовольствием и днем, и ночью.



 Меню
Меню





 Все темы
Все темы




 0
0