Следовые амины и лекарство от шизофрении
Психические заболевания в XX–XXI веке становятся контролируемыми. Все больше людей, которые век назад были бы госпитализированы, ведут практически нормальный образ жизни, постоянно принимая лекарства. Но платить за это приходится тяжелыми побочными эффектами. Рауль Гайнетдинов — о путях к безвредным антипсихотическим препаратам, о настоящих функциях «фальшивых нейротрансмиттеров» и об организации науки в США, Италии и России.

С Раулем Гайнетдиновым и его женой и коллегой Татьяной Сотниковой мы знакомы с 80-х годов прошлого века, в то время мы вместе работали в Институте фармакологии РАМН в Москве. Область его исследований — экспериментальная нейрофармакология и психофармакология, моделирование заболеваний мозга на генетически измененных животных и поиск новых лекарственных мишеней.
Рауль Гайнетдинов — профессор Санкт-Петербургского государственного университета, директор Института трансляционной биомедицины СПбГУ, научный руководитель Клиники высоких медицинских технологий им. Н. И. Пирогова СПбГУ, в недавнем прошлом профессор Сколтеха. Его научная карьера включает 12 лет работы в лаборатории Университета Дьюка (США) и восемь лет руководства лабораторией в Итальянском институте технологий.
Нейромедиатор дофамин интересовал Рауля еще в 80-е, а сейчас о его лидерстве в этой области говорит неофициальное звание «Мистер Дофаминовый Рецептор». Но есть еще одна тема — загадочные следовые амины, которыми увлекались многие специалисты. В какой-то момент все бросили ими заниматься, кроме команды Гайнетдинова. Но прав оказался он.
По следу ускользающих аминов
Начнем с темы твоих исследований, которая не очень широко известна. Что такое следовые амины (трейс-амины) и их рецепторы, чем они интересны?
Я всю жизнь занимался дофамином, но всегда рядом с ним мелькали такие названия, как тирамин, триптамин, бета-фенилэтиламин, октопамин — двоюродные братья дофамина, серотонина и норадреналина, близкие к ним по структуре. Они также относятся к классу биогенных моноаминов, но было непонятно, что же делают эти молекулы в организме. Их называли «фальшивыми нейротрансмиттерами», поскольку считалось, что в отличие от классических моноаминовых нейротрансмиттеров сами они не передают импульс между нейронами, но как-то модулируют функцию своих родственников.
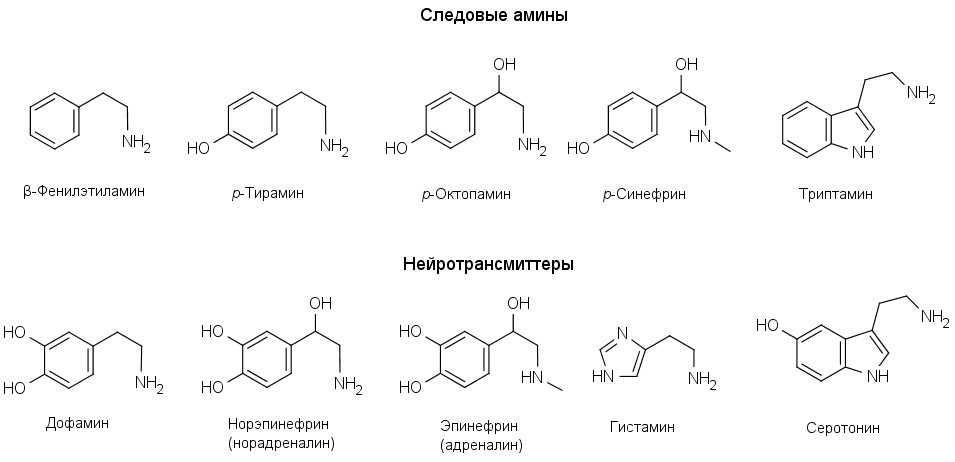
На самом деле следовые амины были описаны гораздо раньше дофамина, серотонина и норадреналина. В 1878 году замечательный польский ученый Маркел Ненцки (Marceli Nencki) открыл первый и наиболее изученный следовой амин бета-фенилэтиламин. Он изучал процесс гниения белков и обнаружил, что, когда разлагается белок яйца, из аминокислоты фенилаланина получается бета-фенилэтиламин. Впоследствии были обнаружены физиологические эффекты бета-фенилэтиламина — когда его вводили кроликам, у них повышалось давление (как потом выяснилось, из-за того, что происходил выброс норадреналина). Это было, по сути, началом классической фармакологии.
А уже в 1970–1980-х годах американские ученые Роберт Лефковиц и Марк Карон, изучая рецепторы адреналина и норадреналина, открыли первые рецепторы, сопряженные с G-белками (GPCR). Это семейство трансмембранных белков, которые передают сигнал извне клетки внутрь и активируют внутриклеточные пути передачи сигнала. Боб Лефковиц и Марк Карон описали и выделили первый из них — бета-2 адренорецептор, который активируется норадреналином и адреналином, — а сегодня уже известно более 800 таких рецепторов. Их гены — это примерно 4% генома человека. Это и вкусовые, и обонятельные, и адренергические, и серотониновые, и дофаминовые, и гистаминовые, и каннабиноидные, и опиоидные, и многие другие рецепторы. И даже родопсин, с помощью которого мы воспринимаем свет, отнесен к семейству GPCR, хотя и был открыт раньше.
До 40% используемых сегодня в клинике лекарственных средств так или иначе влияют на GPCR. Неудивительно, что в 2012 году Боб Лефковиц получил за это Нобелевскую премию. К сожалению, мой второй учитель — Марк Карон не получил этой вполне заслуженной награды.
 Рауль Гайнетдинов (слева), Марк Карон (в центре), Роберт Лефковиц (справа), Лаура Бон и Фанг Лин, соавторы статей в Science и Nature, в Университете Дьюка
Рауль Гайнетдинов (слева), Марк Карон (в центре), Роберт Лефковиц (справа), Лаура Бон и Фанг Лин, соавторы статей в Science и Nature, в Университете Дьюка
В 2001 году другие ученые, работающие в компании Synaptic Corporation, США, нашли новые рецепторы, входящие в семейство GPCR, которые оказались рецепторами следовых аминов. Эти специалисты искали к новым рецепторам лиганды — молекулы, которые с ними связываются: такая обратная задача — есть рецепторы, а чем они активируются, не известно. Статья вышла в PNAS, и мы написали к ней комментарий, который назвали «Идя по следу ускользающих аминов». Коллеги из Synaptic Corporation позже обратились к нам как главным специалистам по GPCR — я тогда уже работал у Марка Карона и Боба Лефковица в Университете Дьюка — и предложили изучать их вместе. Мы конечно же согласились. В тот момент компанию Synaptic Corporation купила датская компания Lundbeck, которая выделила нам грант на эту тему, и Марк Карон поручил мне этим заняться. И я стал изучать эти рецепторы. Так все началось.
И оказалось, что новые рецепторы связываются с этими загадочными аминами? Кстати, почему их назвали следовыми аминами, или трейс-аминами — из-за их малой концентрации в мозге?
Да, действительно, концентрация следовых аминов в мозге в сотни раз ниже, чем у дофамина и серотонина, но скорость их синтеза сравнима. Многие из них активируют эти рецепторы, но не все — поэтому их назвали впоследствии «рецепторы, ассоциированные с трейс-аминами — Trace Amine-Associated Receptor, TAAR. У человека насчитывается шесть функциональных рецепторов трейс-аминов.
Одному рецептору соответствует один трейс-амин?
Там все гораздо сложнее. На сегодня полностью охарактеризован лишь один рецептор TAAR1, он активируется бета-фенилэтиламином, тирамином, немного — октопамином. Нашли вещества, активирующие TAAR5, а для остальных четырех селективные лиганды еще не найдены. На самом деле понятие «трейс-амины» более широкое, и теперь мы считаем, что их должно быть гораздо больше. Мы недавно составили «периодическую таблицу трейс-аминов». Она основана на следующем принципе: если взять любую аминокислоту и удалить у нее кислотную группу — это декарбоксилирование, его проводят ферменты декарбоксилазы, — то мы получим амин. Из фенилаланина получается бета-фенилэтиламин, из триптофана триптамин и т.д. То есть из 20 аминокислот, из которых мы состоим, получается 20 потенциальных трейс-аминов. И уже показано, что большинство из них активирует один или другой TAAR у того или иного животного.
Все они образуются в организме?
Есть несколько способов образования трейс-аминов. Во-первых, это продукт деятельности наших эндогенных декарбоксилаз. Во-вторых, их производят бактериальные декарбоксилазы в ферментированных продуктах питания, поэтому трейс-аминов много в сыре, в вине, в колбасах. Третий источник — микробиота. У нас в ЖКТ постоянно происходит декарбоксилирование аминокислот и образование следовых аминов. Понять, как они влияют на нашу жизнь — это совершенно новая тема исследования. Есть также амины, производные от гормона щитовидной железы, есть производный от холина триметиламин. То есть трейс-аминов очень много, и наша задача — связать их с определенными рецепторами. Другие группы тоже пытаются это сделать.
Галоперидол без побочки
Предполагается, что трейс-амины при помощи рецепторов играют роль регуляторов нейромедиаторов? Это было показано для TAAR1?
Да. Наши коллеги из Lundbeck создали мышей, нокаутных по гену TAAR1, и любезно предоставили нам возможность с ними поработать. Было показано, что у этих мышей усилена дофаминергическая передача. Они были несколько гиперактивными, демонстрировали повышенную двигательную реакцию на введение амфетамина, и было высказано предположение, что эти мыши могут служить моделью шизофрении. Отсюда возникла идея, что агонисты TAAR1 — вещества, которые их активируют, то есть трейс-амины, должны действовать как антипсихотики. А у нас в Дьюке имелись другие нокаутные мышки, у которых много дофамина, — генетическая модель амфетаминовой гиперактивности. Мы ввели им агонисты к TAAR1, и они сразу успокоились. Это было очень убедительно.
 Мышь дикого типа, гетерозигота и мышь, нокаутная по гену дофаминового транспортера (DAT-нокаутная)
Мышь дикого типа, гетерозигота и мышь, нокаутная по гену дофаминового транспортера (DAT-нокаутная)
То есть вещества, связывающиеся с рецептором TAAR1, регулируют уровень дофамина при его избытке и таким образом могут оказывать лечебное действие при шизофрении?
Да. Мы эту работу сделали в 2005 или 2006 году и пришли к выводу, что надо искать новые агонисты к TAAR1. А потом случился такой неожиданный поворот: в 2007 году в Nature вышла статья Линды Бак, которая в свое время получила Нобелевскую премию за открытие механизма работы обонятельных рецепторов, которые тоже сопряжены с G-белками. И в этой статье было заявлено, что все остальные рецепторы трейс-аминов - TAAR2 и прочие — чисто обонятельные. Но не просто обонятельные, а отвечающие за инстинктивные запахи: это феромоны, благодаря им мышка узнает кошку или антилопа тигра, а мы узнаем и отвергаем гнилую пищу.
Авторы этой статьи провели эксперимент, который мне очень сильно не понравился, потому что я уже начал потихоньку изучать другие рецепторы. Они гомогенизировали мозг, посмотрели всю РНК в нем и не нашли транскриптов TAAR2-TAAR9. При этом они не исследовали транскриптом в отдельных клетках. И сделали вывод, что TAAR2-TAAR9 экспрессируются только в обонятельном эпителии, то есть в носу, и больше нигде. И когда они это заявили, то многие нейробиологи и фармакологи перестали заниматься этими рецепторами, почти все бросили работать с TAAR. Кроме меня.
В этом был определенный риск — ведь непонятно, что получится?
Это был большой риск, когда все «спрыгнули с поезда», а я продолжил это дело. Тогда грантов на эту тему не давали, ничего не давали, несколько моих американских коллег в депрессию впали из-за этого. А мы продолжали. Зато теперь оказались лидерами в этой области. Мы создали нокаутных мышей по всем остальным рецепторам и даже нокаутных крыс сделали. И на этих животных мы увидели очень серьезные изменения в мозге, в дофаминовой и серотониновой системах. Видим даже изменения в скорости образования новых нейронов, в нейрогенезе.
Это произошло уже в Санкт-Петербурге? Вы сами здесь делаете нокауты?
Какие-то нам подарили, какие-то купили, но некоторые нокаутные линии мы сделали сами, в нашем Центре трансгенеза и редактирования генома СПбГУ. Моя коллега Елена Леонова освоила метод редактирования генома CRISPR-Cas, и две нокаутные линии мышей мы сделали сами этим методом. Так мы оказались мировыми лидерами в этой области — у нас коллекция нокаутов всех шести рецепторов, которые есть у человека. Такого нет ни в одной лаборатории мира.
А с TAAR1 развитие пошло очень интересно. Когда мы начали с ним работать, мы обнаружили, что он модулирует дофаминовую систему, и стало ясно, что этим надо продолжать заниматься. К сожалению, нам не удалось убедить коллег из Lundbeck в перспективности этой новой мишени, и финансирование проекта было остановлено. В то же время этой темой заинтересовались специалисты швейцарской компании Hoffmann-La Roche, они опять-таки пришли к нам с Марком с предложением изучать вместе агонисты TAAR1. А в это время мы с Татьяной уже переезжали в Италию. У Марка эту тему никто не смог продолжить без нас, поэтому они связались со мной напрямую, и дальше я продолжал уже работать в Италии с Hoffmann-La Roche.
Мы провели цикл исследований, опубликовали статьи, где показали, что агонист TAAR1 может быть принципиально новым средством для лечения шизофрении. Самое главное, что он не блокирует дофаминовый D2 рецептор.
А другие лекарства блокируют? Почему это важно?
Да, все антипсихотические средства, что сегодня используются в клинике, блокируют D2 рецептор. И это причина серьезных побочных действий: нейролептический паркинсонизм, потеря удовольствия от жизни, ожирение. Лекарство, которое их не имеет, — это новое слово в психофармакологии.
La Roche стала проводить клинические исследования, но тут они неожиданно столкнулись с проблемой — выяснилось, что лекарство вызывает побочный эффект у 18% чернокожего населения из-за мутации в одном ферменте. Работа остановилась на четыре года и затем продолжилась уже с новым лекарственным препаратом, сейчас они все еще на второй стадии клинических испытаний.
В это время специалисты другой компании Sunovion, японско-американской, обнаружили, что вещество, с которым они уже давно работали, является также агонистом TAAR1. По словам коллег из этой компании, на одной из конференций я подсказал им эту идею, но я, честно, с трудом это вспоминаю. И они получили такие убедительные данные на второй стадии клинических испытаний, что FDA выдало им так называемое breakthrough therapy designation — обозначение «прорывное лекарственное средство». А это значит, что вторую стадию испытаний могут признать за третью.
Им повезло.
Очень! Это ускоряет выход лекарства года на три. В истории психиатрии это, по-моему, первый раз. Эффект на психозы оказался мощнейшим, а побочных эффектов практически нет, потому что нет блокады D2 рецептора. Это фактически галоперидол без побочки. Пока они разрабатывают его для шизофрении, для психозов, но скорее всего, он будет эффективен и для лечения депрессии и других психиатрических заболеваний. Компания Sunovion сейчас резко рванула вперед, а я их консультирую. Сейчас будет конференция ECNP в Португалии, где я от имени Sunovion рассказываю историю открытия трейс-аминов и их рецепторов. Официальное название лекарства, которое они разрабатывают, Улотаронт (Ulotaront), а La Roche назвала свое лекарство Ралмитаронт (Ralmitaront). Если взять от них первые две буквы, получается Raul — «Рауль». Забавная случайность!
Как успокоить гиперактивную мышь
В обзорной статье про трейс-амины, которую вы с коллегами написали в 2017 году, рассказывается про очень широкий спектр их возможного действия — там и регуляция иммунной системы, и ожирение, и диабет, и нарушения сна. Получается, это такие универсальные регуляторы?
Да, тут все очень интересно. Например, оказалось, что TAAR1 экспрессируется также в поджелудочной железе и регулирует работу клеток островков Лангерганса, то есть, воздействуя на них, можно создавать новые антидиабетические средства. Участие TAAR в работе иммунной системы тоже неудивительно, если вспомнить про запахи гнили. Ведь иммунные клетки как-то должны знать, где происходит повреждение ткани.
Я не буду удивлен, если TAAR окажутся вовлечены во многие другие функции. По сути дела, что такое рецепторы GPCR? Сенсоры, которые передают информацию снаружи клетки внутрь. А это универсальный механизм, вовлеченный во множество функций.
Значит, они могут быть новыми мишенями для действия лекарств в самых разных областях?
Да, и поиском физиологических функций этих рецепторов мы на наших нокаутах и занимаемся. Цель — понять их физиологическую роль для создания принципиально новых лекарственных средств как для заболеваний мозга, так и для других систем организма.
Ты говорил, что для изучения рецепторов трейс-аминов не подходят традиционные методы, это так?
Да, это так, поскольку мы точно не знаем молекулы, которые их активируют. Если знаешь селективные агонисты и антагонисты рецептора, то все гораздо проще: берешь их и изучаешь фармакологическое действие. А если не знаешь, приходится использовать нокаутных животных. Мы убираем рецептор и смотрим — что изменилось в поведении и физиологии. Кроме того, у этих рецепторов довольно низкий уровень экспрессии, и поэтому их трудно детектировать. Если гомогенизировать весь мозг, то вряд ли что-то можно обнаружить. Надо изучать определенные группы клеток.
 DAT нокаутные мыши с заблокированным синтезом дофамина
DAT нокаутные мыши с заблокированным синтезом дофамина
К вопросу о нокаутных мышах. Как их использовать, чтобы изучить роль рецептора — понятно. А чтобы смоделировать психическое заболевание, достаточно для этого нокаута одного гена?
Это важный вопрос. Понятно, что психическое заболевание — сложное, скорее всего, мультикомпонентное. Были статьи о том, что для модели заболевания надо делать одновременно несколько нокаутов. Я считаю, что смоделировать психическое заболевание, скорее всего, невозможно, но можно смоделировать что называется, «эндофенотип», по-простому, симптом. Главные нейрохимические компоненты шизофрении можно получить, если повысить дофамин либо заблокировать NМDА-подтип глутаматных рецепторов. Все сегодня действующие лекарства от шизофрении были найдены на этих моделях. И теперь мы можем делать это путем нокаута соответствующего гена. Мы сделали то и другое на мышах и на крысах.
Почему я поверил в TAAR1 агонисты — потому что это было очень наглядно. Когда у мышки дофамина в пять раз больше нормы, и она невероятно гиперактивная, успокоить ее очень сложно. А TAAR1 агонисты прекрасно ее успокаивают.
Россия — США — Италия — Россия
Давай поговорим о твоей научной карьере. Ты работал в НИИ фармакологии РАМН, где мы были коллегами, занимался дофамином, защитил диссертацию. Как ты оказался в Америке?
Объясню, как я попал к Марку Карону. Его лаборатория в Университете Дьюка очень молекулярная, Карон и Лефковиц — биохимики высочайшего уровня. Марк Карон, чтобы как-то не быть в тени Лефковица, сконцентрировался на дофаминовых рецепторах, и его тогда называли «Мистер Дофаминовый Рецептор». А я занимался нейрофармакологией, в основном дофамином, в экспериментах на животных. В это время появились нокаутные мыши, первая модель была создана в 1989 году, и возникли новые возможности — выключить любой ген, убрать любой белок. Но для этого нужно было исследовать поведение и нейрохимию животных, а не только на уровне клеточных культур изучать. А специалистов, которые умели работать с животными, в Америке тогда было очень мало, большинство уже переключилось на молекулярную биологию.
С Марком Кароном я встречался на конференциях, и когда написал, что хотел бы с ним поработать, он сразу же ответил: приезжай, и взял меня в лабораторию. Он как раз разработал к тому времени мышку с нокаутом дофаминового транспортера, у которой в мозге много дофамина, потому что был нарушен обратный его захват из синаптической щели. И пошло-поехало. Я проработал в Университете Дьюка 12 лет. Это фантастическая возможность — работать с такими уникальными людьми как Марк и Боб (Роберт Лефковиц), проводить исследования на высочайшем научном уровне. В лаборатории было около 40 нокаутных линий мышей, и можно было реализовать любые идеи. За то время, что я там работал, у меня вышло более 100 статей.
Что побудило тебя оставить такую блестящую лабораторию и уехать из Америки в Италию?
Вообще-то я всегда думал о возвращении в Россию, но в 2007 году здесь ничего не было — ни грантов, ни возможности работать. Европа стала промежуточным этапом. Кроме того, когда-то надо было начинать свое дело, пора было создавать свою лабораторию. Начинать это в Америке мне не хотелось, в том числе в силу культурных особенностей, хотелось это сделать в Европе. Мы с Татьяной чувствовали себя европейцами, а американский стиль жизни все-таки несколько иной. А в Италии мне предложили довольно интересный вариант — Итальянский институт технологий в Генуе. Там я получил лабораторию, мы с Татьяной переехали туда со своими мутантными мышкам и стали работать уже независимо.
 Коллектив итальянской лаборатории Гайнетдинова и Марк Карон (в рыжей куртке) на «дофаминовой» конференции
Коллектив итальянской лаборатории Гайнетдинова и Марк Карон (в рыжей куртке) на «дофаминовой» конференции
Почему Итальянский институт технологий в Генуе сравнивают со Сколтехом?
Ну, идея та же самая – создать максимально комфортные условия для того, чтобы фундаментальные научные знания переводить в технологии, чтобы как можно скорее доводить их до патентов, создавать стартапы и т.д. Таких институтов сейчас много в Китае, Корее, Сингапуре, а идея пошла от Массачусетского технологического института, от Калифорнийского технологического института. Это американцы задали такую моду на развитие, максимальную связку с компаниями, с патентами. По такой же концепции был создан и Сколтех, и затем «Сириус».
А как ты вернулся в Россию?
Я всегда хотел вернуться. Появился конкурс мегагрантов, но выиграть его я почему-то не смог. В Россию меня вытащил Сколтех — пригласили занять позицию профессора. Но в Сколтехе в тот момент еще не было лабораторных помещений и не было возможности для экспериментальной работы. Я договорился, что перенесу ее в Санкт-Петербургский государственный университет, где занял должность профессора. На пять лет я «разделился» между Сколтехом и СПбГУ, за это время получил большой грант и полностью осел в Петербурге. Сейчас мы активно сотрудничаем с «Сириусом», это уже отдельная история, развиваем там исследования по нейробиологии вместе с Евгением Будыгиным, нашим общим другом, с которым мы вместе с тобой работали в Институте фармакологии в Москве, потом в США, и теперь он тоже вернулся в Россию.
Трансляция науки в медицину
Хочу спросить про Институт трансляционной медицины в СПбГУ, который ты сейчас возглавляешь. В его названии обозначена концепция — передача фундаментальных знаний в практическую медицину. Как был создан этот институт, на какие средства, что стало толчком?
В 2014 году был объявлен институциональный грант РНФ, 750 млн рублей на пять лет. Предполагалось, что надо создать программу, которая объединяет несколько направлений в университете для какой-то большой идеи. И я предложил эту идею. Моду на трансляционную биомедицину задали американцы, но и у нас это понятие стало в ходу. Трансляционная биомедицина как объединяющая концепция, видимо, понравилась, и мы получили грант на создание института.
Изначально в нем предполагалось пять лабораторий, но мы потихоньку выросли до десяти. Я считаю, что все удачно сложилось, мы опубликовали несколько сотен статей, в том числе в Nature, в Science. Грант РНФ продолжался с 2015 по 2019 годы, потом он закончился, а институт остался. Финансирование теперь не централизованное, каждая группа сама бьется за гранты, но и университет тоже помогает.
А трансляция знаний в медицину происходит? У вас ведь есть Клиника высоких медицинских технологий СПбГУ. Она связана с вашими исследованиями?
Да, руководство СПбГУ очень на это надеется, именно поэтому я был назначен научным руководителем Клиники высоких медицинских технологий им. Н.И. Пирогова СПбГУ. Мы очень активно работаем в этом направлении. Ряд проектов из лабораторий нашего института куда ближе к практике, чем мои исследования.
Следовые амины — это центральная тема твоей лаборатории нейробиологии и молекулярной фармакологии?
Да, но и дофамин также, это моя тема навсегда. Мы много всего интересного по дофамину сделали в Дьюке. Несколько лет тому назад мы в Италии создали гиперактивную крысу, нокаутную по дофаминовому транспортеру. У нее избыток дофамина, и она ведет себя так, как будто все время на амфетамине. Нокаутных крыс вообще очень мало, а такой модели больше нет нигде. На крысах можно делать некоторые сложные поведенческие эксперименты, которые не очень хорошо получаются на мышах.
В США и Италии мы опубликовали большое количество серьезных статей в области дофаминовой нейропередачи, и так получилось, что формально теперь я — Мистер Дофаминовый Рецептор. Но это только формально. У Всемирного общества фармакологов (IUPHAR) есть комитеты по всем группам рецепторов, и они меня попросили возглавить дофаминовый. На самом деле его должен был возглавить мой учитель, непререкаемый авторитет в области дофамина, Марк Карон, но он отказался. На сегодня известно пять типов дофаминовых рецепторов, и если кто-то найдет шестой, то наш комитет должен будет его «проштамповать». И я, конечно же, пригласил Марка в наш комитет.
А что нового стало известно про дофаминовую систему за все это время?
Марк Карон открыл пятый дофаминовый рецептор, были сделаны нокауты всех этих рецепторов, изучены их функции. Мой личный вклад в том, что вместе с моим другом и коллегой Мартином Балью мы открыли новый сигнальный путь, связанный с D2-дофаминовыми рецепторами. Это так называемый аррестин-опосредованный сигнальный путь, и через него, скорее всего, развиваются психозы. Сейчас пытаются найти лекарство, которое влияет не просто на дофаминовый D2-рецептор, а именно на этот сигнальный путь, и это позволит отделить фармакологический эффект от побочных реакций. Мы с Мартином Балью написали большой обзор по дофамину в ведущем фармакологическом журнале мира Pharmacological Reviews, где все это описали, после этого меня и пригласили в председатели дофаминового комитета. И такой же обзор мы написали по трейс-аминам и их рецепторам.
Задам личный вопрос. Как это бывает, когда самый близкий человек — одновременно твоя коллега и соратница по работе? Как вам с Татьяной работается вместе?
Это очень здорово! Мы уже 29 лет вместе работаем! Я считаю, что это большое счастье, когда с близким человеком тебя объединяют одни интересы. И друзья общие, и темы для разговоров всегда есть.
 Рауль и Татьяна в лаборатории
Рауль и Татьяна в лаборатории
Вы дома разговариваете о науке?
Конечно. Все обсуждаем, планируем. У нас с Татьяной с самого начала сложился уникальный тандем. У Марка Карона мы всё своими руками делали, лаборантов у нас не было. Ты знаешь, что эксперимент должен делать один человек с начала и до конца, чтобы не было разницы рук. А мы с Татьяной, когда ставили эксперимент, настолько хорошо чувствовали друг друга, что работали как один человек: она начинает — я доделываю, и наоборот. Я знаю, что ей можно доверять, она знает, что моим рукам можно доверять. Хотя, должен признать, что многие эксперименты она делает лучше, чем я.
«В России работать сложно, но можно»
Рауль, по своему опыту работы ты можешь сказать, какие принципиальные отличия в организации науки в США, Европе и России?
Когда я приехал в Америку в 1996 году, нигде в мире научная работа не была так хорошо организована, как там. Тогда выбора не было: есть Америка — и весь остальной мир. Если хочешь делать карьеру мирового масштаба в науке, надо было ехать в Америку. Но за эти годы там вырос уровень бюрократизма, все стало гораздо сложнее. Кроме того, за это время они собрали ученых со всего мира, а финансирование науки повышали, по-моему, в последний раз при Клинтоне. Произошел перебор в количестве ученых, и теперь в Америке стало очень сложно получить гранты. Но в остальном работать там гораздо эффективнее, например, все заказанное уже через неделю стоит на столе. Когда я там был, Марк Карон мог содержать 40 линий нокаутных мышей, а сейчас уже нет — и дороже стало все, и грантов меньше. То есть сейчас там начались свои сложности, но все равно, если говорить про организацию научной работы, она там оптимальна.
Италия достаточно дезорганизованная страна, там бывают проблемы с заказами, с финансированием. Хотя Итальянскому институту технологий все в Италии завидовали — у всех денег нет, а им дали, так же как у нас когда-то завидовали Сколтеху, а теперь «Сириусу». За всю Европу не скажу, это очень зависит от страны, например, в Германии, говорят, получше. Но сейчас разница между Европой и Америкой стала гораздо меньше, чем раньше. И Китай серьезно подрос.
А как ты оцениваешь организацию науки в России?
Что касается России, то она конечно же растет в этом плане. Несколько лет назад не было смысла возвращаться, потому что я не смог бы здесь работать. Но сейчас Российский научный фонд работает очень эффективно, я бы поставил ему пятерку, он работает даже лучше, чем американская система. Но, к сожалению, этого финансирования недостаточно, его надо повышать. Закрытие РФФИ — тоже не очень хорошая идея, потому что РФФИ поддерживал маленькие группы, которые не могли прорваться к большим грантам.
Проблемы с заказами — это наша головная боль, все приходит в лучшем случае через полгода, и цена вдвое выше, чем в Америке: накрутки на перевоз, таможню, налоги. Я сам удивляюсь, как мы еще выживаем и смогли опубликовать столько статей из России, удивлен производительностью нашей лаборатории и института в целом.
В России работать сложно, но можно, скажем так. Надо быть готовым к политическим сложностям, к финансовым неопределенностям, к тому, что каждый год с января ты не знаешь свое финансирование. Нет постоянства.
Я это всем говорю, когда общаюсь на высоком уровне с влиятельными людьми в руководстве страны: что надо в разы повышать финансирование и облегчать научную деятельность на каждом этапе, чтобы достойно конкурировать. Я могу в какой-то степени конкурировать в мировом масштабе, потому что у меня остались связи, у меня много коллег в Америке, Италии, Германии, с которыми я могу какие-то вопросы решать более оперативно. А вот если человек не пожил на Западе, не имеет таких связей, то будет очень сложно.
Видишь ли ты тенденцию на изоляцию российской науки от мировой, и насколько это опасно?
Честно говоря, в нашем институте мы ее не видим. Наш институт международный: из десяти лабораторий четыре возглавляются учеными, которые работают на Западе, для которых это вторые лаборатории; и шесть — учеными, которые поработали за границей, вернулись и живут здесь. Часть нашего успеха в том, что мы все вписаны в мировую науку. Нас попытки изоляции не касаются, могу так сказать. Может быть, мы в каком-то особенном положении? Не знаю. В Сколтехе и «Сириусе» тоже таких много.
Хорошо помню, как мы лет десять назад беседовали и я спрашивала о перспективах твоего возвращения в Россию. Ты тогда сказал, что вы с Татьяной очень хотели бы вернуться, но «на белом коне». В итоге у тебя есть ощущение, что так получилось?
В общем, да. Я считаю, что так оно и вышло. Я много чему научился, работал в лучших университетах, в лучших лабораториях мира. Дружил и продолжаю дружить с нобелевскими лауреатами. И теперь, я считаю, здесь в России работаю на мировом уровне, оставаясь лидером в своей области. У нас получилось.


 Меню
Меню





 Все темы
Все темы




 0
0