Зачем бактерии наследуют плохие воспоминания
Когда мы говорим «CRISPR-Cas», мы чаще всего думаем про инструмент, с помощью которого ученые редактируют геномы клеток растений, животных и человека. Но на самом деле CRISPR-Cas-системы возникли в клетках бактерий для защиты от вирусов. Эта иммунная система при кажущейся простоте воспроизводит едва ли не все функции нашего «многоклеточного» иммунитета. Константин Северинов рассказывает о том, что происходит в бактериальной клетке, когда ее заражает вирус-мутант, «научившийся» преодолевать CRISPR-иммунитет. У бактерии есть план и на этот случай.

Константин Северинов — доктор биологических наук, генеральный директор ООО «Биотехнологический кампус», главный научный сотрудник Института биологии гена РАН, профессор Ратгерского университета (Нью-Джерси, США).
Иммунитет от бабушки
Расскажите, пожалуйста, о CRISPR как иммунной системе прокариот. Просто чтобы все вспомнили, что это и как работает.
CRISPR-Cas-системы — это способ, с помощью которого бактерии защищаются от вирусов. Этих вирусов называют бактериофагами. Бактериофагов очень много, в штуках их гораздо больше, чем самих бактерий, и они способны очень эффективно и быстро убивать бактерии (бактериофаг означает «пожиратель бактерий»). Поэтому, казалось бы, бактерий быть не должно, потому что все они должны быть уничтожены вирусами. Но тогда и вирусов тоже быть не должно, они исчезнут, как только уничтожат всех бактерий. Очевидно, что ни того ни другого не происходит: и бактерии, и их вирусы существуют на Земле миллиарды лет. Оказывается, выживают лишь те бактерии, у которых есть способы бороться с вирусами. Казалось бы, если бактерии могут бороться с вирусами, то вирусов не должно быть. Но этого тоже не происходит, потому что вирусы «придумывают» способы противодействия защитным системам бактерий. На самом деле, конечно, никто ничего не придумывает, просто происходит отбор наиболее приспособленных вирусов и бактерий, именно они оставляют больше потомства. Идет бесконечная гонка вооружений: у бактерий есть масса способов защиты, у вирусов масса способов преодоления защиты. Так и живут, в смертельном объятии и зависимости друг от друга.
Один из способов защиты бактерий от бактериофагов называется CRISPR-Cas. Принцип действия CRISPR-Cas похож на ставший близким многим людям принцип вакцинации от вирусной инфекции, но есть и важные отличия. Когда начали использовать «Спутник V», люди, не отягощенные биологическими знаниями, высказывали соображение, что прививаться не надо, потому что вакцина содержит живой вирус и ДНК вируса может попасть в наш с вами драгоценный геном и изменить его, а также геномы нашего потомства. К механизму действия вакцины «Спутник» это не имеет никакого отношения, но система CRISPR-Cas работает примерно таким образом.
Если у бактерии есть защитный механизм CRISPR-Cas, то кусочек вирусной ДНК, проникшей в клетку во время инфекции, может встроиться в ДНК самой бактерии, оказаться частью ее генома. Кусочки ДНК вируса вставляются в определенное место, которое называется «CRISPR-кассета». В CRISPR-кассете накапливаются воспоминания о вирусах, с которыми бактерия встречалась и, несмотря на инфекцию, смогла выжить. Встроенные в кассету кусочки ДНК вирусов называются «спейсеры». Фактически встраивание спейсера является вакцинацией. Если встраивание произошло, то при повторном заражении тем же вирусом начинают действовать специальные белки Cas. Это белки-ножницы, они могут программируемым образом разрезать молекулы ДНК. Программирование осуществляется так: Cas-белок физически связывается со спейсером, точнее, с его РНК-копией. По-английски и по-русски эта копия называется гидом. Как музейный гид подводит посетителя к определенной картине, так и CRISPR-гид подводит белок-ножницы к определенному участку ДНК — а именно к участку, соответствующему гиду. Естественно, такой участок будет в ДНК ранее «запомненного» вируса. Когда вирус, идентичный тому, который оставил в CRISPR-кассете воспоминание о себе, попадет в клетку, то он будет узнан запрограммированными Cas-ножницами, его ДНК будет уничтожена, а клетка выживет. Вот, собственно, и все.
Называется это адаптивной иммунностью —свойство адаптивности, приспособляемости CRISPR-Cas в некотором смысле аналогично нашему адаптивному иммунитету на основе антител: бактерии сталкиваются с вирусами, с которыми они ранее никогда не встречались, и «научаются» быть к ним устойчивыми. Но, в отличие от нас с вами, бактерии адаптируются наследственно: если бактериальная клетка-бабушка столкнулась с вирусом и выжила, вставив в свой геном кусочек ДНК этого вируса, то ее внуки, правнуки и так далее тоже будут иметь «воспоминание» о перенесенной бабулей инфекции, и, значит, к вирусам такого типа будут устойчивы.
Что контрастирует с нашей ситуацией: у людей и животных иммунитет не наследуется.
Да, у нас, к сожалению или к счастью, это не так. Тот факт, что я переболел ветрянкой, вовсе не означает, что мои дети будут устойчивы к этому заболеванию в момент рождения. Наша адаптивная иммунность очень интересно и сложно устроена, но она умирает вместе с нами. Наши дети рождаются иммунологически наивными и вынуждены сами бороться со всеми паразитами, которых они встретят на жизненном пути (ну, или вакцинироваться).
То, что вирус умеет ускользать от вакцины, это тоже близкая нам тема. Сейчас все гадают, защитит ли нас вакцинный иммунитет от новых штаммов омикрона. У бактерий и бактериофагов то же самое?
Да, все очень похоже. Известно огромное число случаев взаимодействия двух существ, одно из которых выступает в роли хозяина, а другое — в роли паразита. Хозяину нужно уйти из-под влияния паразита, а паразиту, чтобы не умереть, нужно как-то с этим бороться и «следовать» за хозяином. Коронавирус «уходил» от защитного действия вакцин за счет того, что в результате естественного отбора получали преимущество варианты с мутациями, которые хуже связывались с антителами, выработанными в ответ на вакцинацию или ранее перенесенную инфекцию. В случае с CRISPR-Cas история точно такая же.
На бумаге все просто: CRISPR-Cas запоминает вирусы, ты передаешь эти воспоминания своим потомкам, проблема решена. Знаете, как в сказке Киплинга: «И все шло хорошо, не правда ли, мой мальчик?». Но по факту все не так. Спейсер —то есть участок ДНК вируса, который вставился в ДНК бактерии, воспоминание о встрече с вирусом —имеет довольно большую длину, около 30 нуклеотидов. Так и должно быть: если участок ДНК, который вы используете как метку для вируса, слишком короткий, то он может найтись и в вашей собственной ДНК, Cas-ножницы раскусят ее, и вы погибнете от аутоиммунного заболевания — опять же термин, который у многих на слуху в связи с нашими недавними бедами.
Один из способов избежать этой опасности — сделать спейсер достаточно длинным. Можно статистически показать, что «слово» длиной в 30 букв, взятое из ДНК вируса, гарантированно в геноме бактерии не найдется. Проблема в том, что вирусу достаточно изменить лишь одну букву в том участке ДНК, который встроился в бактерию, чтобы защита исчезла. Ножницы не будут узнавать измененный вирус-мутант, а значит, он будет убивать клетки. Такой вирус называется вирусом-эскапистом, escape означает «убежать» — он убегает из-под действия иммунитета.
То есть если бабушка-бактерия была заражена каким-то вирусом, умудрилась встроить кусочек ДНК в свой геном и передала эту ценную информацию своим внучкам, то это наследство может оказаться бесполезным, так как при копировании вирусной ДНК наверняка возникнет вирус, у которого в участке, узнаваемом гид-РНК, хотя бы одна буква будет изменена. Это происходит само собой, ровно та же ситуация, как и с мутантными вариантами коронавируса. Вирус-эскапист вас благополучно заразит, и вы, соответственно, помрете. С этим надо что-то делать. Вы не хотите иметь одноразовую иммунную систему, вы хотите иметь систему, способную обеспечить борьбу с генетическим паразитом, который не только способен, но обязательно будет изменяться.
Дарвиновская E. coli и ламарковская лактобактерия
Десять лет назад мы опубликовали работу, в которой показали, что в самом деле у клетки, у CRISPR-Cas-системы, есть способ бороться с вирусами-эскапистами, которые с неизбежностью будут возникать в ответ на приобретение защитного спейсера.
Тогда, 10 лет назад, из общих соображений было ясно, что такое должно происходить — гонка вооружений между вирусом и бактерией?
У англичан есть выражение — «если бы я был таким же умным, как моя жена после того, как событие произошло». Тогда был абсолютно серьезный разговор о том, зачем нужна CRISPR-Cas-защита, если ее можно очень легко обойти. У вирусов есть масса способов борьбы с защитными системами бактерий, и каждый из них задним числом можно рационализировать и сказать, что так и должно быть. Но то, что так должно быть, вовсе не означает, что так и будет. Например, можно себе представить, что те же CRISPR-Cas-системы могли быть у нас с вами. Но это не так. В клетках высших организмов CRISPR-Cas-систем нет.
Хороший вопрос, почему нет. Может быть, потому что у нас есть ядро?
Ядро у нас есть, но уж если на то пошло, все то, из-за чего люди обычные, не ученые, знают и любят CRISPR-Cas — ну не знают и не любят, а краем уха слышали, — связано с возможностями генного редактирования. А генное редактирование делается путем доставки бактериального белка Cas-ножницы, запрограммированного гидом, в ядра наших клеток, где они программируемым образом раскусывают ДНК. Так что никаких принципиальных запретов на использование CRISPR-Cas в клетках, имеющих ядра, нет. Но факт состоит в том, что в природе этого нет.
А тогда как вы вышли на эту идею, как это все началось?
Все интересное начинается по воле случая. CRISPR-Cas-системы открыли лишь в 2007 году. Это открытие прекрасно демонстрирует идиосинкратичность биологии. Один из классических опытов молекулярной биологии — так называемый флуктуационный тест Лурии — Дельбрюка. Он был сделан в 1943 году. Генетик Сальвадор Лурия и Макс Дельбрюк, теоретический физик, приятель и коллега Тимофеева-Ресовского, изучали следующий вопрос: как бактерии становятся устойчивыми к вирусам? Было две точки зрения на это (мы сейчас начинаем совсем от Гостомысла). Классические генетики, изучавшие дрозофил, понимали, что есть наследственные изменения, есть гены, хотя не было понятно, в чем природа гена. При этом считалось, что менделевская наследственность в виде генов, чем бы эти гены ни были, есть только у высших организмов. А у бактерий, считалось, ее нету. Бактерий сложно отличить друг от друга, все они в микроскоп какие-то маленькие, палочки, спиральки, кругляшки-кокки, а биохимически они очень разнообразны. По разнообразию возможностей поглощения различных питательных веществ в качестве корма или производства каких-то веществ они нам дают сто очков вперед. И считалось, что свойства бактерий формирует внешняя среда — они по Ламарку живут, приспосабливаясь, адаптируясь к изменяющимся условиям внешней среды.
Так, но опыт Лурии и Дельбрюка…
Лурия и Дельбрюк изучали возникновение устойчивых к вирусу бактерий. Очень простой опыт: берешь большое количество бактерий, наливаешь на них еще большее количество вируса и считаешь количество выживших бактерий. Выживает очень мало. Можно задаться вопросом: они выжили потому, что в таком ламарковском стиле тужились-тужились и каким-то образом превозмогли вирус, произошла адаптация, научились с ним бороться — или же среди бактерий с самого начала существовали устойчивые к вирусу клетки, до того, как вирус появился.
Так вот, опыт Лурии — Дельбрюка ответил на этот вопрос однозначно: мутации предсуществуют вне зависимости от их будущей пользы, а их носители получают преимущество при изменении условий. Классический дарвиновский отбор. Результат, полученный Лурией и Дельбрюком, означал, что наследственность у бактерий устроена так же, как у высших организмов, что у них есть гены. В конечном счете этот результат позволил понять, как работают гены у всех живых существ, сформулировать центральную догму молекулярной биологии, расшифровать генетический код.
Итак, начиная с этого классического эксперимента 1943 года, который принес Лурии и Дельбрюку Нобелевскую премию, все знали, нас всех учили, что мутации устойчивости к вирусу появляются не в связи с их пользой, а возникают спонтанно. Но это знание было основано на одном очень красивом и простом опыте и на одной экспериментальной модели, бактерии под названием «кишечная палочка» и ее вирусе под названием «бактериофаг Т1». В 2007 году, когда опубликовали первую статьи по защитному действию CRISPR, стало понятно, насколько основания нашей науки в некотором смысле зыбки. Дело в том, что CRISPR-Cas был открыт при изучении лактобактерии Streptococcus thermophilus, которая сыр делает из молока, и бактериофага, который ее заражает. Так вот, если провести опыт Лурии и Дельбрюка не на кишечной палочке, а на термофильном стрептококке, результат будет противоположным: чистая адаптивность, наследуемая устойчивость к вирусу появляются только после встречи с вирусом, а не предсуществуют. Почему? Потому что устойчивость к вирусам у стрептококка определяется действием CRISPR-Cas-системы. А CRISPR-Cas-система делает вас устойчивым к вирусу только тогда, когда вирус вас заразит, и вы, если повезет, захватите кусочек вирусной ДНК. А если вируса нету, то и кусочек его ДНК взять в качестве защитного спейсера, очевидно, неоткуда.
Значит, Лурия и Дельбрюк увидели бы приспособленность по Ламарку, если бы взяли лактобактерию, а не кишечную палочку?
Да. Лактобактерии тогда, как и сейчас, были широко доступны, потому что их использует молочная промышленность. Вирусов лактобактерий сколько угодно. Если бы Лурия и Дельбрюк провели свой опыт на стрептококке, они получили бы результат, формально соответствующий представлениям Лысенко. Слава богу, что они выбрали кишечную палочку… Но есть нюанс. Дело в том, что когда в 2007 году был сделан первый опыт, продемонстрировавший адаптивную иммунность за счет подхватывания кусочков ДНК в CRISPR-кассету у термофильных стрептококков, был уже известен геном кишечной палочки и было понятно, что у нее тоже есть CRISPR-Cas-система. И если она у нее есть, чего же ради она не работает? Ведь за 60 лет активного изучения кишечной палочки в сотнях лабораторий никто не видел ее действия.
О пользе дурацких опытов
У меня была прекрасная аспирантка Ксения Пугач, из МГУ, правда, работала она в моей американской лаборатории — и она повторяла опыты Дельбрюка. Ксения заражала кишечную палочку вирусом М13 и смотрела, не будет ли среди устойчивых к вирусу бактерий таких, которые стали устойчивыми за счет приобретения спейсера в CRISPR-кассету. Те, которые устойчивы по дельбрюковскому механизму, — к ним вирус не может присоединиться и заразить их. Помните, у коронавируса есть S-белок, он взаимодействует с АСЕ2-рецептором на поверхности наших клеток, и это взаимодействие необходимо для проникновения в клетку. Если рецептор изменится, то вирус не сможет заразить клетку. Так вот, дельбрюковские мутации все были такого рода, клетки меняли рецептор на своей поверхности за счет случайной мутации и становились устойчивыми.
То есть клетка предотвращает инфекцию, а не убивает вирус, который уже проник в клетку?
Именно так. А устойчивость за счет CRISPR возникает по-другому. Вирус должен свою ДНК ввести внутрь, потом в CRISPR-кассету должен вставиться кусочек вирусной ДНК, и такая бактерия должна побороть инфекцию и выжить. Ксения заражала клетки вирусом и проверяла бактерий, которые выжили, — увеличилась ли у них CRISPR-кассета за счет вставки новых спейсеров. Это можно посмотреть с помощью простой ПЦР, но на самом деле это много работы, сотни реакций надо поставитъ. И конечно, она показала, что Дельбрюк прав, никаких изменений длины CRISPR-кассеты у устойчивых бактерий не происходило. Клетки становились устойчивыми к вирусу не за счет приобретения новых спейсеров. Мы решили, что, может быть, это происходит потому, что CRISPR-система какая-то поломанная. Чтобы проверить, так ли это, Ксения методами молекулярной биологии кусочек ДНК вируса вставила в CRISPR-кассету. Клетки сами этого по какой то причине делать не хотели, но мы это сделали за них. Когда она заразила такие модифицированные клетки кишечной палочки вирусом, выяснилось, что все клетки устойчивы. Это означает, что CRISPR-система работает, защищает кишечную палочку, но с иммунизацией какая-то проблема. Что очень глупо: зачем иметь такую прекрасную защитную систему, если она не способна сделать первый, важнейший шаг и приобрести защитный спейсер?
Странно, да.
Потом Ксения сделала совсем, казалось бы, дурацкий опыт. Показав, что клетки устойчивы после того, как им вставили спейсер насильно, она зачем-то все равно стала заражать клетки и изучать те, которые выжили. Безумный опыт: вы заражаете вирусом клетки, которые, вы знаете, устойчивы к нему, и смотрите, что с ними стало. Что вы хотите увидеть, в чем смысл? Но в этом, собственно, главная прелесть самостоятельно работающих аспирантов или студентов. Они иногда делают опыты, которые делать нет смысла, и получают из этих опытов важные результаты.
И что произошло?
Обнаружилось, что после заражения исходно устойчивых клеток у подавляющего большинства клеток CRISPR-кассеты оказались удлиненными. Некоторые содержали один дополнительный спейсер, а большинство — пять, шесть и болeе новых спейсеров, приобретенных из различных участков вирусного генома. Какая-то идиотская ситуация: если вы уже можете бороться с вирусом за счет спейсера, вставленного аспирантом, то зачем вам набирать новые спейсеры?
Мы назвали это явление примированием и разобрались, за счет чего оно происходит. Оказалось, что когда мы заражаем вирусами наших защищенных бактерий, мы заражаем их не одним вирусом, а миллионами, миллиардами вирусных частиц, и среди них всегда есть случайно появившиеся эскаписты, у которых есть одна-две замены относительно спейсера, имеющегося у бактерий. Вирусы-эскаписты способны заражать клетки, которые защищены от большинства вирусных частиц. И казалось бы, тут должен наступить геймовер, потому что вирус-эскапист — это такой волк в овчарне, ему есть где развернуться, его потомство перезаразит все клетки, и они все умрут. Но не тут-то было. Оказывается, что, хотя незначительное изменение ДНК у вирусов-эскапистов не позволяет белку Cas-ножницы раскусить ДНК вируса, оно позволяет распознать вирусную ДНК как нечто чужеродное. Знаете, как страшное воспоминание, с которым ты бороться не можешь, но понимаешь, что дело нехорошо. Реально это происходит на уровне взаимодействия нуклеиновых кислот. Если соответствие между гидом в белке Cas-ножницы и ДНК вируса будет точным, то узнавание ДНК вируса будет прочным, и это сигнал для разрезания ДНК. А если соответствие не вполне точное, то какое-то остаточное взаимодействие есть, но оно менее прочное.
И эта сниженная прочность служит сигналом для примирования?
Она говорит CRISPR-Cas-системе: тут появился кто-то, я не уверен, но, кажется, это не то, что нам надо, раскусить не могу. В CRISPR-Cas-системе есть дополнительные белки, не Cas-ножницы, а другие, называются Cas1 и Cas2, которые и ответственны за выбор новых спейсеров и вставление их в кассеты. Эти белки привлекаются именно к той молекуле ДНК, которая неточно соответствует спейсеру, и как бешеные начинают набирать из нее новые спейсеры слева, справа от того места, которое было неточно узнано.
Вся эта конструкция ползет по ДНК?
Да, набегают машинки, которые двигаются по той же самой молекуле, с которой произошло неточное узнавание, выбирают в ней кусочки ДНК в 30 нуклеотидов и вставляют их в CRISPR-кассету. Делают это один, два, три, пять, много раз. Вот, собственно, примирование в этом и заключается. И это биологически очень осмысленно, потому что пусть ваша бабушка не дала вам достаточно иммунологических знаний для того, чтобы убивать измененные вирусы, но она передает вам привет в виде способности их узнавать и набирать новые спейсеры из ДНК измененных вирусов. И так как вы набираете не один, а несколько спейсеров, вирусу становится очень сложно стать эскапистом, потому что для этого ему нужно будет одновременно получить мутации во многих местах. Это будет крайне редкое событие.
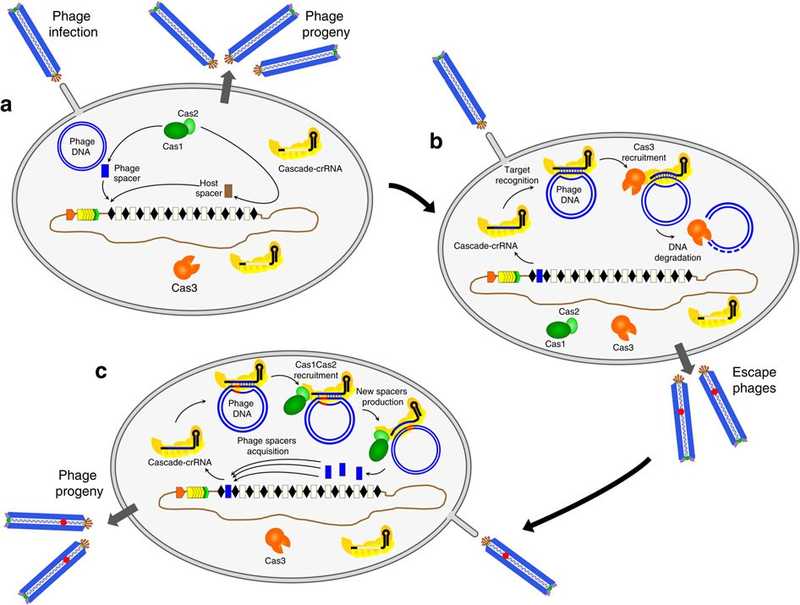 «Наивные» клетки кишечной палочки без спейсеров, нацеленных на фаг М13, приобретают спейсеры достаточно редко, и это может быть спейсер из собственной ДНК бактерии (а). Клетки, приобретающие фаговые спейсеры, становятся устойчивыми к фагу дикого типа, но не к фагам-эскапистам (b). Когда клетка, несущая фаговый спейсер, инфицирована фагом-эскапистом, запускается адаптивное приобретение новых спейсеров из генома этого фага (с). По: Nat Comm, 2012. DOI: 10.1038/ncomms1937
«Наивные» клетки кишечной палочки без спейсеров, нацеленных на фаг М13, приобретают спейсеры достаточно редко, и это может быть спейсер из собственной ДНК бактерии (а). Клетки, приобретающие фаговые спейсеры, становятся устойчивыми к фагу дикого типа, но не к фагам-эскапистам (b). Когда клетка, несущая фаговый спейсер, инфицирована фагом-эскапистом, запускается адаптивное приобретение новых спейсеров из генома этого фага (с). По: Nat Comm, 2012. DOI: 10.1038/ncomms1937
А это необычная ситуация, когда сразу пять спейсеров приобретается? Без примирования обычно один спейсер из одного фага?
Без примирования обычно ничего не приобретается, хорошо, если один спейсер, но и это очень редкое событие. Вообще — теперь-то мы это знаем — есть два механизма приобретения новых спейсеров, наивный и примированный. Наивный предполагает, что вы не имеете предварительных знаний о чужеродной ДНК, каким-то образом случайно захватываете кусочек ДНК вируса и становитесь устойчивым. Но если бы такой механизм в клетке работал постоянно, то в случае не зараженных вирусом бактерий источником новых спейсеров был бы ее собственный геном. Если вы подхватите свою собственную ДНК в качестве спейсера, белок Cas-ножницы вас убьет.
Аутоиммунная реакция произойдет?
Именно. Поэтому наивная адаптация не может быть эффективной, она смертельна в отсутствие инфекции. Вставление ДНК в CRISPR-кассету, как мы теперь знаем, подавлено в нормальной ситуации, но активируется заражением вируса, как именно, никто не знает. Когда клетка заражена вирусом, она начинает вставлять кусочки ДНК в CRISPR-кассету. Большинство этих кусочков будет из генома бактерии просто потому, что геном бактерий в сотни раз больше генома вируса. Это приведет к гибели бактерии. Погибнув, зараженная клетка не станет источником новых вирусов, инфекция не распространится по популяции, братики и сестрички погибшей бактерии выживут. Представьте себе, что первый зараженный коронавирусом заболел и умер, не успев ни с кем пообщаться. Он или она сослужили бы всему человечеству большую службу.
Почему лихорадка Эбола не распространяется так быстро, как коронавирус…
Да-да. CRISPR-система в отсутствие инфекции плохо приобретает новые спейсеры, ее активирует заражение вирусом, и тот, кто систему эту включил, часто умирает на благо всех остальных. Поэтому, собственно, Дельбрюк ничего такого и не видел. Но очень-очень небольшое количество клеток, которые случайно вставили себе в кассету кусочек вирусной ДНК, — выживают, они выиграли в лотерею, им сильно повезло. И казалось бы, нужно сохранить такую прелесть на будущее. Но вирус может легко уйти от этой защиты, поменяв лишь одну букву, став эскапистом. Система примирования позволяет закрепить случайно обретенный успех, набрать побольше кусочков из этого вируса при последующем заражении и снова стать устойчивым, может даже абсолютно, полностью устойчивым. Вот такая милая история.
Одноклеточные и многоклеточные
Очень красивый механизм и очень красивая работа. А вот вопрос немного в сторону: бактерии сбрасывают спейсеры, фрагменты геномов тех фагов, с которыми давно не встречаются?
Да, они это делают. У бактерии геном маленький, в тысячу раз меньше нашего, и понятно, что если бактерии существуют миллиарды лет и все время пользуются CRISPR-Cas, то их геном должен расти как на дрожжах. Все воспоминания о встречах с вирусами оказались бы записаны, и не было бы места ни для чего другого. Буква R в слове CRISPR — от английского repeat, то есть «повтор». CRISPR-кассета состоит из спейсеров от разных вирусов и повторов между ними. Повторы — это просто одинаковые последовательности ДНК. У бактерий и у нас с вами есть процесс гомологичной рекомбинации: если есть две одинаковые последовательности, то возникает петля, и все, что между ними, выбрасывается. Гомологичная рекомбинация позволяет контролировать длину CRISPR-кассет. Тем не менее они бывают очень разными по размеру: есть организмы, у которых до 500 спейсеров, а у кишечной палочки меньше 20. Как определяется оптимальное количество спейсеров, до конца не ясно.
Я думал, что смогу ответить на этот вопрос, воспользовавшись результатами опыта Ричарда Ленски. Он 30 лет растил одних и тех же бактерий — такой классический эксперимент по эволюции. Каждый день пересевал их из одной колбы в другую и по чуть-чуть замораживал. Вся его лаборатория — это холодильники с десятками тысяч образцов замороженных культур. Можно взять баночки 1991 и 2022 года, вынуть оттуда, казалось бы, одних и тех же бактерий, сравнить какие-нибудь их свойства и заодно определить последовательности их геномов. Сам Ричард Ленски только что ушел на пенсию и кому-то завещал эти свои холодильники. Короче говоря, я решил, что нужно попросить у него его бактерий и посмотреть, не произошло ли там чего с CRISPR-кассетами… Но выяснилось, что, к сожалению, он в свой исходный эксперимент заложил довольно редкий вариант кишечной палочки, в которой CRISPR-Cas-системы просто нет. Не повезло.
Сравнения CRISPR-Cas-системы с нашим адаптивным иммунитетом — насколько они правомерны? Они проясняют или, наоборот, запутывают?
Нет, почему. И тот, и другой механизм адаптивны, решают задачу приобретения иммунности к тому, чего вы еще никогда не встречали. В нашем случае это делается за счет рекомбинации ДНК в клетках иммунной системы, получения новых последовательностей ДНК, кодирующих антитела. Это такая очень замечательная машинка… Помните, у Лема были рассказы про Трурля и Клапауция?
О да. «Кибериада».
И один раз Трурль придумал машину для генерации стихов. А потом этот искусственный интеллект, Великан Духа, стихи отправлял в космос, у него был мощный передатчик, и все стали облетать эту галактику, потому что весь эфир был заполонен дурацкими стишками. И наша иммунная система, и система CRISPR работают, как машина Трурля, тоже генерируют случайно, только не стихи, а последовательности ДНК, кодирующие антитела или спейсеры, в надежде на то, что некоторые из них смогут распознать заранее не известных патогенов. CRISPR работает за счет создания гигантского разнообразия бактерий с разными приобретенными спейсерами. Разнообразие антител создается за счет комбинирования и потери генов иммуноглобулинов и создания новых, ранее не существовавших вариантов. В обеих системах есть обратные связи: если антитело или спейсер, этот стишок трурлевский, нашел своего «читателя», то есть чужеродную мишень, то количество клеток, производящих такое антитело или имеющих такой спейсер, увеличивается. Но если антитело или спейсер узнаёт что-то ваше собственное, то вы удаляете такие клетки.
Многоклеточные могут генерировать клетки с разными геномами, которые будут бороться с неизвестными веществами, а потом отомрут. Потомкам мы передадим геном без изменений, чтобы они заново решали свои иммунологические проблемы. Бактерии — одноклеточные, все, что есть у материнской клетки, передаeтся потомству. Для них стратегия терять ДНК, как это происходит у нас при генерации разнообразия, плохая. Лучше набирать что-то новое, а потом контролировать это, выбрасывая ненужное.
Как специалист по CRISPR-Cas, что вы думаете о фаготерапии? О ней много говорят в последнее время из-за угрозы лекарственной устойчивости у патогенных бактерий. Может фаготерапия стать альтернативой антибиотикотерапии?
Увлечение фаготерапией связано, с одной стороны, с честным желанием найти альтернативу антибиотикам, а с другой стороны, на этом можно получить деньги. Ограниченные, но тем не менее. Я в первой жизни специалист по фагам. Мне кажется, что серьезного практического значения фаготерапия иметь не будет.
Антибиотики можно производить в больших количествах, их можно химически модифицировать, их просто очищать, и критерии чистоты для них понятны и контролируемы и т.д., и т.п. Фаги предлагаются как способ решения проблемы антибиотикоустойчивости. Но у бактерий есть масса способов борьбы с ними, и очевидно, что широкое применение фагов очень быстро приведет к отбору устойчивых к ним вариантов. Кроме того, фаги являются агентами горизонтального переноса. Они «нужны» бактериям, если хотите, для того, чтобы обмениваться генами, в том числе они переносят и устойчивость к антибиотикам, а мы не хотим, чтобы это происходило. Получать фаги в индустриальных масштабах в стандартизованном виде довольно сложно. В препаратах фага всегда будут присутствовать мутанты, которые будут накапливаться при изменении условий непредсказуемым образом. Препараты фагов будут меняться со временем. Те немногие заводики по производству фагов, которые остались в России — в Перми, в Иркутске, еще где-то, — все вроде производят одно и то же, но работает (или, вернее, не работает) оно очень по-разному. Вирусы эволюционируют быстро, и они вовсе не обязательно эволюционируют в сторону большей способности заражать бактерий, которых вы хотите уничтожить. Для наработки вирусов нужно культивировать большие объемы бактериальных культур; напомню, речь идет о патогенных бактериях. Это опасно. Бактериофаги иммуногенны, против них вырабатываются антитела, то есть использовать их многократно проблематично.
То есть когда мы принимаем фаг, у нас будет иммунная реакция на него?
Безусловно… Продолжим. Убиение бактерий вирусом, то есть лизис, буквально, лопание бактериальных клеток, не обязательно хорошо, потому что у многих бактерий есть токсины, которые высвобождаются именно при лизисе, и если это случится массово, то пациенту может стать хуже, а не лучше. В общем, есть проблемы.
Что делать?
Как повлияла пандемия на life sciences в мире: стало лучше, стало хуже?
В Штатах в течение почти двух лет нельзя было нормально в лабораториях работать. Социальная дистанция, маски, работа сменами и все такое. Студентов не было, ходили только те, кто необходим. Была общая нервозность в связи с тем, что гранты все равно шли, отчитываться по ним нужно, а результаты получать сложно. В общем, много времени было потеряно. Но зато широкое распространение получили онлайн-коллоквиумы и конференции, милое дело: сидишь дома, а у тебя на экране сотня людей со всего мира, кто-то рассказывает о своей работе, можно что-то обсудить, договориться о сотрудничестве… Сейчас все более-менее в норму пришло. Офлайн-конференции опять начались, можно ездить, давать семинары и лекции, личное общение очень важно.
В разгар пандемии многие вдруг стали заниматься коронавирусом, имея мало понимания о том, что это такое. Просто деньги на это давали. Похожая ситуация была в начале девяностых: было очень много плохого ресёрча по СПИДу, щедро поддержанного государством, Национальными институтами здравоохранения, потому что был социальный заказ на такого рода работу. Масштаб бедствия был меньше, но тем не менее. Всякая муть в этой области скоро спадет, а серьезные исследования по коронавирусам и другим потенциально опасным нестандартным возбудителям останутся, и их будет больше, чем раньше. Это хорошо.
А в российской науке, уже не в связи с коронавирусом? Я каждую неделю слышу, что кто-то уезжает, останавливаются проекты. Все у нас плохо или еще не совсем?
За последние 10 лет я вложил много сил в построение хорошей биологической программы в Сколтехе. В августе 2022 года я оттуда ушел из-за санкций США; как американский гражданин я не могу там работать. С начала этого года много ребят, работавших со мной в Сколтехе, уехало. Часть уехала на постдоковские позиции в США и Европе, это очень хорошо. Другие находятся в различных граничащих с Россией странах и приобретают там уникальный жизненный опыт, который, однако, не связан с профессиональным развитием. Около половины остались в России. Они, я думаю, должны быть готовы к длительному периоду нахождения вне основного научного дискурса по причине фактической невозможности общения с коллегами (я имею в виду конференции), из-за сложностей с получением реагентов и материалов, из-за проблем с поддержанием в рабочем состоянии оборудования, из-за вероятного резкого уменьшения возможности публиковаться, потому что невозможно будет платить за публикации в международных журналах. Те российские журналы, которые можно было, несмотря на смешные импакт-факторы, считать лидерами, хотя бы исторически значимыми, вроде «Молекулярной биологии», выведены из международных баз, а значит, того, что в них публикуют, почти никто не увидит.
Если про оборудование — сейчас говорят об импортозамещении, об отечественных секвенаторах…
Я руковожу крупным генетическим центром. В принципе мы к идее импортозамещения относимся положительно, но всегда стоит вопрос, что под этим словом подразумевается, какая там реальная доля замещения. И конечно же вопрос качества, надежности и так далее.
Поясните, пожалуйста: как связаны федеральная программа развития гентехнологий, ваш центр полногеномного секвенирования и компания «Биотек Кампус»?
Есть ФНТП «Развитие генетических технологий» под эгидой Министерства образования и науки. Технологическим партнером этой программы является компания ПО «НК «Роснефть». Ее инициатива в рамках партнерства состоит в том, чтобы построить мощный центр геномного секвенирования. Мы его, слава богу, построили и оборудовали, сейчас начинаем секвенировать образцы. Цель — за несколько лет определить сто тысяч полных геномов россиян, создать базу хранения этой генетической информации и инструменты для ее анализа. Этой деятельностью занимается ООО «Биотек Кампус», которым я руковожу.
Про геномы приятно слышать. Наконец-то и у нас будут свои сто тысяч геномов, как в Великобритании и других развитых странах.
В Великобритании уже миллион. Для нас это не вопрос собственно цифр, а вопрос создания ядра, базы, которая может быть использована для практической медицины; анализ определенных нами геномов позволит лучше диагностировать, а в ряде случаев лечить, например, детские иммунодефициты и заболевания крови.
А на каких приборах вы секвенируете?
Мы работаем на приборах китайской компании BGI.
И какое впечатление от них?
Нам поставлены последние высокопроизводительные модели. По ТТХ они сопоставимы с американскими приборами. Их непросто было получить, они сейчас тестируются специалистами. Мы должны на них к концу года сделать тысячу полных геномов, тогда посмотрим. BGI — это исключительный случай успеха и прозорливости. Около 15 лет назад их отключили от индустриальной и инженерной поддержки приборов американской компании Illumina, несмотря на то, что у них был крупнейший парк этих приборов в мире. После этого они купили небольшой американский стартап с альтернативной технологией и в течение 10 лет вкладывали огромное количество денег и сил в ее развитие, и в итоге довели приборы до кондиции. Я считаю это потрясающим успехом.
И сейчас в Китае с секвенированием все намного лучше, чем в России?
Я бы сказал, что с этим в Китае сейчас лучше всех на свете. По крайней мере, до пандемии очень многие европейские и американские ученые секвенировали свои образцы в Китае и Корее. Просто в Корее нету своей производственной базы, а в Китае она есть.
Можно ли ругать российскую биологию и молодых биологов
Некоторые патриоты обижаются, что Северинов называет российскую биологию незначительной в мировом масштабе. Это правда непатриотично?
Я бы расширил: в мировом масштабе не только биология, а вообще вся современная российская наука не очень значительное явление. Это было признано на самых высоких трибунах, например, во время переизбрания на третий срок президента Путина. В части предвыборной программы, связанной с наукой, были планы к 2020 году увеличить процент российских научных статей, по-моему, с 1,5 до 1,75%, масштаб цифр был именно такой. По всем направлениям, не только по биологии, мы хорошо если составляем 2% от мирового продукта, измеряемого в количестве научных статей, в то время как США и Китай производят более 30% каждый. Обижаться здесь особо не на что. Наш вклад, может, и не соответствует нашему географическому размеру, но соответствует количеству людей, живущих в России, нас же только 145 миллионов человек (в США 332 млн, в Китае 1,4 млрд. — PCR.NEWS), количеству денег, которое выделяется на науку, и количеству и качеству ученых, которые у нас есть. Учитывая то, что во всех известных мне областях, по крайней мере, в естественных науках, условия для занятий наукой у нас существенно хуже, чем в других развитых странах, мне даже кажется, что мы производим больше, чем можно было бы ожидать. Плохо то, что те статьи, которые мы производим, в среднем по качеству, оцениваемому как по уровню цитирования, так и по уровню журналов, ниже, чем у лидеров.
Что бы вы посоветовали тем, кто сейчас работает в российской науке? Не все могут получить позицию за границей.
Сейчас сложно что-то прогнозировать, уверенности в будущем очень мало. Все не могут уехать хотя бы потому, что всех там не могут принять, никаких специальных программ по абсорбции ученых из России не существует. Уехать сейчас сложнее, чем раньше. С годами будет еще сложнее, потому что, наверное, если не отставание, то размежевание будет продолжаться. Цель ведь не может быть в том, чтобы уехать абы куда, уезжать следует туда, где будет возможность профессионального роста и развития, где тебя хотят видеть и где ты можешь показать себя лучшим способом. В идеале вообще речь должна идти о том, что ты приносишь что-то уникальное в ту лабораторию, куда ты приезжаешь, нельзя просто быть рабочими руками.
Я твердо убежден в том, что наука может делаться только за счет сотрудничества и не может делаться в одной стране. Именно потому, что мы составляем лишь 2% от мировой науки, нам гораздо выгоднее быть интегрированными в мировую науку, чем им — чтобы мы были интегрированы. Если бы я был начальником, я бы попытался делать так, чтобы возможности научного обмена, несмотря на все происходящее, расширялись, а не схлопывались. Причем упор должен быть на обмене именно со странами, которые находятся впереди нас. Исторически, с точки зрения дипломатии это хорошая политика. Опыт показывает, что когда не о чем говорить, говорят о музыке, балете и науке.
А как вы видите ваши собственные актуальные задачи?
Мои научные интересы связаны с защитными системами бактерий, антибиотиками и бактериофагами. Вместе с сотрудниками, выпускниками и студентами МГУ, Физтеха и Сколтеха, мы продолжаем эти исследования. В теперешних условиях важно сделать так, чтобы эти работы продолжались на высоком международном уровне, не стали провинциальными. Мне интересно создавать новые сущности в России, которые бы работали не хуже западных и не являлись простой калькой западных практик, поскольку такие кальки не работают. Я считаю своей заслугой создание биологического центра и образовательной программы в Сколтехе, там все было сделано по уму и работало настолько хорошо, насколько это вообще возможно в России. Сейчас моя задача — создать геномный центр. Казалось бы, это не научная задача вообще, таких центров уже с десяток по всему миру, но в России, несмотря на увлечение геномикой в течение последних 10–15 лет, работающего центра такого масштаба создано не было. Мы делаем фабрику, где будут 24 часа в сутки, 7 дней в неделю три года секвенировать геномы. К сожалению, почему-то такой технологический процесс в России до сих пор не был организован. Не потому, что у нас нет секвенаторов. Но оценки, сделанные рядом ведомств, показывают, что из нескольких сотен разбросанных по стране разномастных машин используются хорошо если 20%, да и те не на полную мощность.
Почему так?
Я думаю, многие наивно считают, что прибор стоимостью в миллион долларов решает все вопросы. Дальше все устроится само собой. Но стоимость прибора составляет максимум 5% стоимости владения им. Многие фирмы сейчас вообще поставляют приборы бесплатно. Поэтому, купив секвенатор, но не обеспечив постоянное поступление реагентов на несколько лет — жизненный цикл прибора — и не имея специалистов, способных на нем работать, вы просто выбросили деньги. Одно из достоинств того центра, где я сейчас работаю, заключается в том, что там эту экономику понимают и имеются средства для обеспечения работы на весь жизненный цикл прибора. Мы контрактовались на все сразу. Нам не нужно будет бегать с выпученными глазами, искать деньги и реагенты, потому что иначе процесс остановится. И кадры мы себе готовим сами на корпоративной магистерской программе. Вообще все это довольно очевидные вещи.
Последний вопрос, деликатный. Одна из ваших бывших сотрудниц рассказывала в соцсети, как вы ее обидели, плохо отозвались о ней и ее работе. Насколько резок может быть научный руководитель, когда человек не справляется? Что можно ему сказать, чего нельзя?
У меня 55 защищенных аспирантов, из них шесть человек имеют свои лаборатории в Европе и США. Я со всеми поддерживаю отношения. Пять человек ушли из аспирантуры, не защитившись. Это нормально, все не могут и не должны становиться кандидатами наук. Если человека нужно заставлять работать, заинтересовывать, плясать перед ним, а он смотрит на тебя стеклянными глазами, подрабатывает где-то… Я считаю, что если надо заставлять, то не надо заставлять. Надо расходиться. Эта девушка — одна из тех, кто не защитился. Сейчас она занимается развитием персональных брендов ученых, что мне кажется инфоцыганством. Мне кажется, что бренд ученого — это результаты его или ее работы, остальное от лукавого.
По поводу резкости, я думаю, что это очень зависит... Ксюша Пугач сделала главное наблюдение для статьи, которую мы обсуждали. Потом много людей работало, но первый инсайт был получен именно ею. По-моему, я на нее орал и, кажется, топал ногами, когда она сделала «неправильный» и ненужный, с моей точки зрения, эксперимент, спрашивал: «Зачем вы вообще это сделали, это же очевидная потеря времени?» Впрочем, она тоже за словом в карман не лезла. Для меня это большой урок: не надо считать себя шибко умным. Но в любом случае, здесь человек сделал что-то лишнее, не по протоколу, это не была ситуация, когда кого-то надо было заинтересовывать собственной работой, скорее, наоборот.
Одна из причин, почему у российских ученых с публикациями плохо: многие рассчитывают, что все ими сказанное будет принято на ура, а любую критику воспринимают как персональную или даже как проявление русофобии. Все не так. Как якобы говорил Ландау, «я не говорю, что он дурак, я говорю, что его идеи дурацкие». Хорошая наука подразумевает критический анализ, разбор, обсуждение. В идеале он не должен переходить на личности, но по факту личностный аспект всегда будет. Например, вы посылаете статью в журнал, вам приходит отлуп, и вы, если находитесь в соответствующем состоянии, найдете там то, что воспримете как персональные нападки. Язык иногда бывает очень такой, обидный, что ли… Но вам нужно воспринять это не как персональную обиду — рецензент вообще вас не знает, он или она читает написанный вами текст с описанием ваших экспериментов, — а как способ разобраться и улучшить статью, свою работу. Если вы станете профессиональным ученым, реальность вашего бытия будет в том, что вы будете не получать гранты, ваши статьи будут отклонять, вы будете общаться с какими-то идиотскими администраторами, ваши коллеги — очень умные, хорошие люди — будут пытаться вас опередить и так далее. И вы будете такими же по отношению к коллегам. Идея, что жизнь профессионального ученого — это сплошная благостность, неверная. Вот, кстати, точная цитата из Ландау по этому поводу: «Нельзя делать научную карьеру на одной порядочности. Это неминуемо приведет к тому, что не будет ни науки, ни порядочности!»
А хоть бы и была благостность, жесткая критика будет все равно.
И ее нужно уметь воспринимать. Я считаю, что руководитель (да и вообще никто) не может оскорблять сотрудников на пустом месте. Хотя бы потому, что это совершенно непродуктивно. Руководитель, который так делает, не получит результатов. Но быть предельно жестким на внутрилабораторных семинарах крайне важно, потому что это готовит человека к успешной карьере. Одно дело, когда вы слышите неприятные вещи от кого-то, кто вас знает, это тренинг, вы становитесь лучше как ученый, и у вас кожа становится толще. И совсем другое дело, когда вы получаете письма с холодными или насмешливыми суждениями после вынесения результатов нескольких лет своей работы на публичное обсуждение, в журнал и так далее. Когда вы пишете грант, вы с первого раза ничего не получите, и со второго, и с третьего, наверное, тоже не получите. Может быть, с пятой попытки получите. Но вам до этой пятой попытки нужно дорасти, не разувериться в себе. Курсов, где учат такой устойчивости, нет, но, мне кажется, в лаборатории, где вы работаете, на семинарах, вы этому можете и должны научиться… Я вот у Спирина работал, у Мирзабекова, это всегда было так: выступление на семинаре — очень большой стресс. И этот стресс помогает вам сделать все по верхней планке, с полной отдачей.
Нельзя говорить «ты дурак», но говорить «идея твоя дурацкая, работа твоя дурацкая» можно и нужно?
Да, условно говоря, вопрос, как ты дошел до жизни такой, что ты сделал эксперимент, но не подумал о том, что не сможешь интерпретировать его результаты, потому что ты забыл самую малость — сделать какой-то контроль, — это крайне важно. Потому что человек тратит деньги, время свое и других. Если он делает опыт без положительного и отрицательного контроля, а потом делает вывод, это означает, что он или она не понимает, что делает. Как ты можешь не знать статьи в своей области? Ученый, который не понимает, что и зачем он делает, профессионально непригоден. Вообще, ученый должен сам быть своим самым жестким критиком, все, что он может услышать от коллег, он сам должен подумать про себя заранее и найти ответы — для себя и для других.


 Меню
Меню





 Все темы
Все темы




 0
0