Агрегаты белков в ооцитах мышей хранятся в суперорганеллах
Ооциты — одни из самых долгоживущих клеток в организме, и из-за этого они уязвимы к накоплению белковых агрегатов. Испанские и немецкие ученые выяснили, что в ооцитах мышей агрегаты хранятся в особых суперорганеллах ELVA, содержащих лизосомы и протеасомы. Эти органеллы активируются при созревании ооцитов, устраняя агрегаты до образования эмбриона. ELVA могут встречаться также в нейронах и стволовых клетках, а нарушение их работы исследователи считают потенциальной причиной бесплодия.
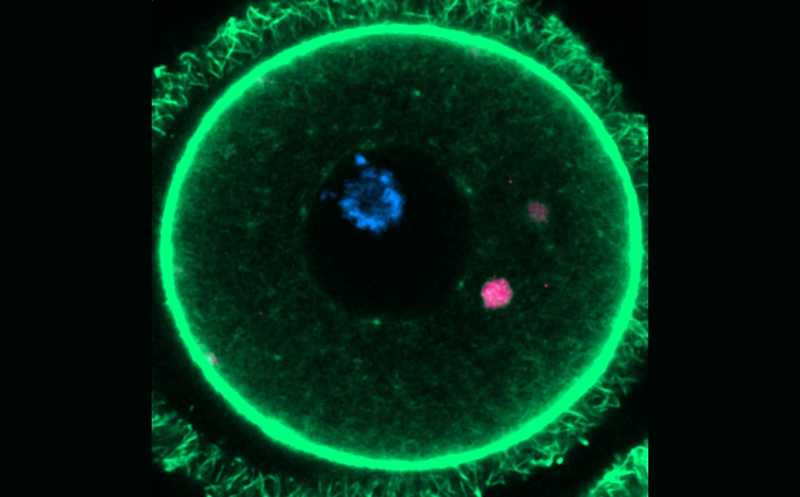
ELVA в ооците мыши (отмечена розовым).
Credit:
Gabriele Zaffagnini/Centro de Regulación Genómica |
пресс-релиз
В клетках есть несколько путей устранения поврежденных или неправильно сложенных белков, способных образовывать токсичные агрегаты. Растворимые полипептиды устраняются с помощью убиквитин-протеасомной системы, а нерастворимые агрегаты убиквитинированных белков разлагаются в лизосомах путем аутофагии. Ооциты — одни из самых долгоживущих клеток в организме, но до сих пор было неизвестно, как они борются с накоплением агрегировавших белков. Считается, что они особенно уязвимы перед этой проблемой, так как, в отличие от других клеток, не могут избавиться от агрегатов путем простого деления клетки. В то же время цитоплазма ооцитов должна оставаться «чистой», так как в ней развивается эмбрион.
Ученые из Германии и Испании выяснили, что в ооцитах мышей агрегаты белков скапливаются в суперорганеллах — ELVA (endolysosomal vesicular assemblies — эндолизосомальные везикулярные комплексы). Для детального изучения этих суперорганелл биологи исследовали мышиные ооциты, яйцеклетки и эмбрионы на раннем сроке с помощью визуализации живых клеток, электронной микроскопии и протеомики.
На первом этапе ученые окрасили ооциты и яйцеклетки красителем Proteostat, который выявляет агрегаты белков. В них обнаружилось множество микрометровых скоплений агрегировавших белков, которые исчезали при образовании эмбриона. Эти агрегаты колокализовались с лизосомами и убиквитином. На основе этого ученые сделали вывод, что ELVA — это немембранные компартменты, в состав которых входят различные компоненты, в том числе мембранные органеллы. При этом протеомный анализ показал, что составляющие ELVA удерживаются вместе белком RUFY1. Его экспрессия повышена в ооцитах по сравнению с соматическими тканями, а сам он склонен к полимеризации и сосредоточен на периферии ELVA. При удалении RUFY1 из клеток ELVA не сформировывались, и авторы заключили, что именно он входит в состав белкового матрикса суперорганелл. В свою очередь, при оверэкспрессии RUFY1 в соматических клетках также самособирались похожие на ELVA структуры, что подтвердило роль этого белка.
По мере созревания ооцитов ELVA уменьшались в числе, но при этом повышался их объем, то есть они объединялись между собой. Исследователи отметили, что в незрелых ооцитах ELVA были распространены по всей цитоплазме, но по мере созревания перемещались к периферии клеток. Чтобы определить, управляются ли эти перемещения цитоскелетом, ученые обрабатывали клетки цитохалазином D, который ингибирует полимеризацию актина, либо нокодазолом, который мешает полимеризации микротрубочек. В первом случае ELVA прекращали перемещаться по мере созревания ооцитов, а во втором изменений не было. Это позволило заключить, что актиновый цитоскелет участвует в перемещении ELVA из цитоплазмы к периферии клеток.
Как показали дальнейшие эксперименты, ELVA начинают деградировать белковые агрегаты только при созревании ооцитов. Лизосомы, входящие в их состав, становились активны только в яйцеклетках, а протеасомная активность повышалась на последних стадиях роста и созревания ооцитов. Это согласовалось с более ранними наблюдениями, согласно которым агрегаты белков, которые еще были в яйцеклетках, исчезали при образовании эмбриона. При этом ученые выяснили, что деградация проходила значительно менее эффективно, если EVLA не перемещались к периферии клеток, а оставались в цитоплазме. Само это перемещение нужно клеткам для экзоцитоза содержимого лизосом, в ходе которого ооциты избавляются от ELVA и содержащихся в них агрегатов белков.
Ученые решили проверить гипотезу о том, что ELVA используются ооцитами для «защиты» будущих эмбрионов от токсичных агрегатов. Для этого они отследили судьбы двух белков, ассоциированных с патологиями: KIT (продукт протоонкогена, экспрессия которого строго регулируется во время созревания ооцитов и эмбриогенеза) и TDP-43 (РНК-связывающий белок, который образует агрегаты при нейродегенеративных заболеваниях и подвергается убиквитинированию в яйцеклетках). В незрелых ооцитах KIT и TDP-43 располагались внутри ELVA, а по мере их созревания их уровни снижались вплоть до полного исчезновения этих белков в эмбрионах на стадиях одной и двух клеток. Агрегаты этих белков разлагались в лизосомах внутри ELVA. Если же лизосомальную активность искусственно нарушали, то агрегаты накапливались в ELVA, что приводило к образованию дефектных яйцеклеток. В результате этого 60% эмбрионов не смогли развиться до стадии бластоцисты из-за белковых агрегатов.
Таким образом, ученые показали существование новой суперорганеллы, с помощью которой ооциты избавляются от агрегатов белков. Ранее ELVA упоминались и другими исследователями, которые принимали их за эндосомы или агрегированные везикулы. Авторы публикации в Cell же настаивают, что ELVA представляют собой специфические компартменты клеток, которые содержат макромолекулы и органеллы, выполняющие одну и ту же функцию — очистку клеток от белков. Они предполагают, что подобные структуры могут присутствовать и в других долгоживущих клетках, например, в покоящихся стволовых клетках. В предыдущих исследованиях уже упоминалось, что в гемопоэтических стволовых клетках до их активации и деления агрегаты белков хранятся в особых компартментах, которые называли аггресомами. В нейронах агрегаты белков сохраняются вблизи протеасом или кластеров везикул. В обоих случаях описанные структуры могут быть ELVA.
Исследователи отметили, что их открытие может быть важным для понимания причин женского бесплодия. Они предположили, что по мере старения работа ELVA нарушается, из-за чего ооциты и яйцеклетки больше не могут эффективно очищаться от агрегатов. Это, в свою очередь, способно приводить к проблемам с зачатием.
Описан новый механизм защиты от агрегации неправильно свернутых белков у нематоды
Источник
Zaffagnini, G. et al. Mouse oocytes sequester aggregated proteins in degradative super-organelles. // Cell, 187, 1-18 (2024). DOI: 10.1016/j.cell.2024.01.031


 Меню
Меню





 Все темы
Все темы




 0
0








