Описан новый механизм защиты от агрегации неправильно свернутых белков у нематоды
Старение и некоторые болезни связаны с отложением белков с патологической конформацией, от которых одни ткани страдают больше, чем другие. Авторы статьи в PLOS Biology изучили причины такой специфичности у нематоды Caenorhabditis elegans и описали новый путь удаления неправильно свернутых белков SAPA (safeguard against protein aggregation) — предохранение от белковой агрегации.
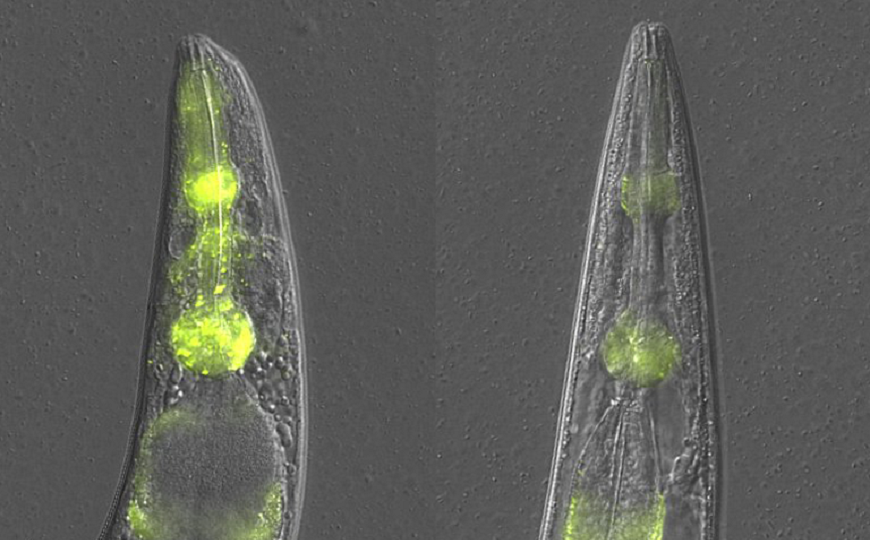
В ходе старения нарушается протеостаз, в том числе накапливаются неправильно свернутые (потерявшие нормальную конформацию) белки. Этот процесс также лежит в основе ряда нейродегенераций, в том числе болезни Альцгеймера, при которой он затрагивает сразу две молекулы: тау-белок и бета-амилоид. Для так называемых конформационных болезней характерна тканевая специфичность. Белковые агрегаты по какой-то причине гораздо быстрее накапливаются в одних тканях, чем в других.
Причину тканевой специфичности протеостаза выяснили немецкие и британские ученые. Работу проводили на нематоде Caenorhabditis elegans. Как ни странно, выключение у нематоды трех главных систем, которые устраняют «патологические» белки, — шаперонов, протеасом и макроаутофагии — снизило количество белковых агрегатов в мышцах глотки. При этом в мышцах основной части тела C. elegans агрегатов, как и следует ожидать, стало больше.
Разбираясь с полученными парадоксальными результатами, авторы описали новый путь удаления неправильно свернутых белков. Они назвали его safeguard against protein aggregation (SAPA) — предохранение от белковой агрегации.
Ученые рассмотрели два типа тканей C. elegans в ходе естественного старения: гладкомышечные клетки глотки и поперечнополосатые мышцы тела. Изменения в обеих тканях начались задолго до того, как нематоды стали «пожилыми».
Для того, чтобы изучить связь накопления белковых агрегатов и работы систем контроля качества белков (protein quality control, PQC), авторы использовали флуоресцентные метки для двух белков. Первый — Ras-подобный ГТФ-связывающий белок rhoA (RHO-1), обнаруженный в тканях глоточных мышц, второй — альфа-изоформа казеинкиназы I (KIN-19), который экспрессируется в мышцах как глотки, так и стенки тела.
Оба белка относятся к глобулярным и по мере старения животного склонны переходить в патологическую конформацию, образуя агрегаты, которые не растворяют даже сильные ПАВ. Такие патологические белковые скопления проявляют свойства амилоидов вроде тех, что вызывают конформационные болезни. При этом сверхэкспрессированный в глоточных мышцах RHO-1 отличается от KIN-19 активным формированием агрегатов даже у молодых животных.
Авторы использовали РНК-интерференци. (RNAi) для ингибирования всех трех основных систем контроля качества белков у C. elegans. Опосредованный шаперонами фолдинг «выключили», подействовав на фактор теплового шока 1 (HSF-1) — основной фактор транскрипции, регулирующий экспрессию шаперонов. Зависящую от протеасом деградацию белков прекратили за счет нокдауна генов, кодирующих их субъединицы 20S и 19S (белки PBS-3, PAS-6, RPT-6). Макроаутофагию ингибировали, подействовав на два главных компонента этого пути (ATG-18 и UNC-51).
К удивлению авторов, такое жесткое подавление систем протеостаза произвело на ткани червя противоположное действие. Агрегация KIN-19 в мышцах стенки тела ожидаемо усилилась, а вот в мышцах глотки амилоидных агрегатов обоих белков (RHO-1 и KIN-19) стало заметно меньше — об этом свидетельствует уменьшение флуоресцентного сигнала. Эффект отмечен как у молодых животных (2–4 день взрослой стадии развития), так и у уже вышедших из репродуктивного возраста нематод (6–10 день).
Существенно, что агрегаты RHO-1 в глоточных мышцах молодых животных могут мешать им питаться и нарушать адаптацию даже вне зависимости от старения. Поэтому регуляция этого процесса за счет особого тканеспецифичного механизма (SAPA) может иметь важное приспособительное значение и подвергаться отбору в ходе эволюции. При этом механизм SAPA оказался специфичен к белковому субстрату: он не влияет на образование агрегатов из PAB-1 (polyadenylate-binding protein 1).
Далее с помощью KIN-19 и RHO-1, меченных mEOS2, авторы выяснили, что SAPA предотвращает главным образом формирование агрегатов обоих белков de novo.
Чтобы выявить факторы, задействованные в SAPA, исследователи установили гены, которые специфически активируются при этом процессе. Для этого они секвенировали РНК всех тканей C. elegans и обнаружили 12 генов, экспрессия которых усилилась, и которые могут играть роль в предотвращении накопления белков в глоточных мышцах. Два из них имеют гомологи в геноме человека: C01B10.4 близок к гену бутирилхолинэстеразы, а C53A5.11 — к гену актинсвязывающего белка IPP. Функции 5 из 12 кандидатных генов не установлены, однако известно, что они входят в систему внутриклеточного ответа на патогены.
Нокдаун 8 из 12 генов с помощью РНК-интерференции способствовал образованию агрегатов RHO-1 в мышцах глотки у нематод с мутациями в гене hsf1, что дополнительно подтвердило их важность для SAPA.
Таким образом, исследователи охарактеризовали новый механизм, специфически подавляющий накопление белков и их протеотоксичность в отдельных тканях при выключении основной PQC-системы. Он может объяснить неравномерность накопления белков в различных клетках и тканях с возрастом. Авторы считают, что их находка поможет разработать новые виды терапии.
Источник:
Jung R., et al. A safety mechanism enables tissue-specific resistance to protein aggregation during aging in C. elegans // PLoS Biol (2023), 21(9): e3002284. Published: September 14, 2023. DOI: 10.1371/journal.pbio.3002284


 Меню
Меню





 Все темы
Все темы




 0
0








