Активация апоптоза тормозит рост рака поджелудочной железы, резистентного к химиотерапии
Пациенты с квазимезенхимальным типом рака поджелудочной железы имеют очень мало возможностей для терапии. Проведя масштабный скрининг, ученые нашли соединение AI-10-49, которое активирует экспрессию проапоптотического гена NOXA и таким образом способствует апоптозу в опухолевых клетках.
Квазимезенхимальный подтип рака поджелудочной железы известен своей резистентностью к химиотерапии. Команда под руководством ученых из медицинского университетского комплекса Шарите (Берлин) провела скрининг терапевтических молекул и нашла соединение, которое увеличивает продукцию проапоптотического белка NOXA, тем самым способствуя апоптозу раковых клеток.
В клетках квазимезенхимального подтипа рака поджелудочной железы, в отличие от других подтипов, наблюдается экспрессия гена NOXA, однако белка, по-видимому, все же недостаточно для апоптоза. Исследователи решили найти вещество, которое повысило бы экспрессию. Они провели скрининг потенциальных терапевтических агентов на клетках с геном NOXA и без него.
Из 1842 соединений отобрали 50 кандидатов, которые демонстрировали влияние на жизнеспособность NOXA-положительных клеток. Тем не менее только одна из 50 терапевтических молекул не подавляла клетки с нокаутом гена (следовательно, действовала специфично) и имела дозозависимый эффект. Это было соединение AI-10-49, уже известное как ингибитор взаимодействия транскрипционного фактора RUNX1 и онкофузионного белка CBFβ-SMHHC. Флуориметрический анализ показал, что добавление AI-10-49 увеличивает частоту апоптоза среди клеток. Кроме того, в них повышалась экспрессия гена NOXA.
Ученые выяснили, что из всей группы RUNX белков только RUNX1 способен регулировать экспрессию NOXA. Клетки с нокаутированным геном RUNX1 демонстрировали пониженную экспрессию. Более того, при добавлении миРНК, нацеленных на RUNX1, доза препарата, приводящая к 50%-ному снижению пролиферативной активности клеток, уменьшалась в два раза.
Свои результаты ученые подтвердили с помощью биоинформатического анализа данных из базы данных ICGC. Они обнаружили отрицательную корреляцию между уровнями экспрессии генов RUNX1 и NOXA в образцах квазимезенхимального рака поджелудочной железы. Также они продемонстрировали, что эффект от препарата сохраняется в органоидах, выращенных на основе биоматериала пациентов.
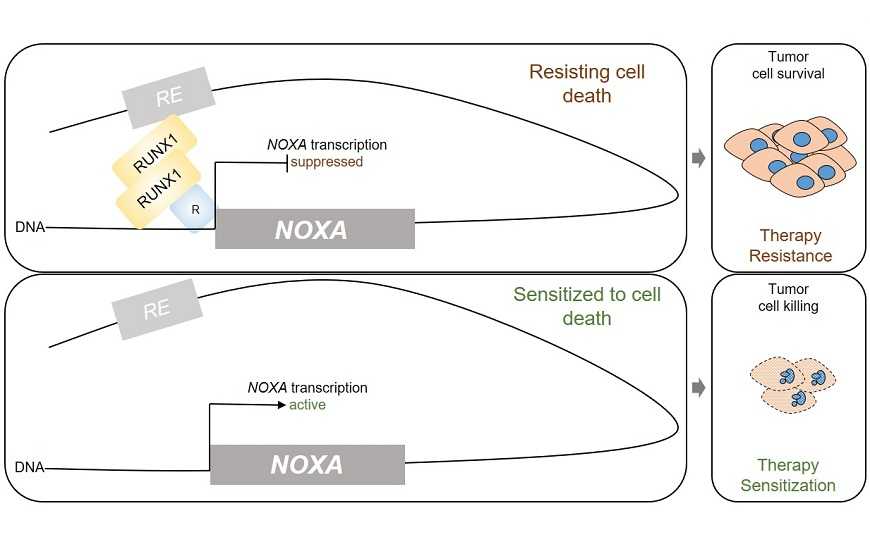
В последующих экспериментах исследователи выяснили, как RUNX1 регулирует экспрессию NOXA. Используя методы ChIP-Seq и 4C, они обнаружили, что ингибирование RUNX1 изменяет эпигенетический ландшафт и, в частности, обогащает метками H3K27ac (ацетилированными гистонами Н3, которые указывают на регионы хроматина с более высоким уровнем транскрипции) промотор NOXA. Более того, ученые нашли сайт связывания RUNX1 ниже гена NOXA, взаимодействующий с другими участками хроматина. Они назвали его dBS1. При добавлении AI-10-49 связывание dBS1 с RUNX1 снижалось, а пространственное взаимодействие этого участка с остальным хроматином исчезало. Таким образом, AI-10-49 мешает взаимодействию RUNX1 с dBS1 и снимает ингибирование экспрессии NOXA (см. рисунок).
Терапевтические препараты, нацеленные на изменение транскрипционного ландшафта в раковых клетках — перспективный метод лечения рака поджелудочной железы, резистентного к традиционным терапевтическим подходам. В будущем исследователи планируют проверить, насколько этот метод эффективен против других видов рака.
Источник
Doffo, J. et al. NOXA expression drives synthetic lethality to RUNX1 inhibition in pancreatic cancer. PNAS 119, (2022). doi: 10.1073/pnas.2105691119
Препринт на bioRxiv


 Меню
Меню





 Все темы
Все темы




 0
0








