Бактерии кишечника регулируют метилирование ДНК в клетках хозяина
Заболевания кишечника так или иначе связаны с бактериальными сообществами, проживающими в нем. Однако природа этих связей изучена недостаточно. Группа ученых из Израиля и Германии обнаружила эпигенетический механизм, с помощью которого микробиота контролирует реакцию кишечника на воспаление.
Немецкие и израильские ученые решили проверить недавно предложенную гипотезу о том, что бактерии контролируют клетки кишечного эпителия с помощью эпигенетического механизма. В пользу гипотезы говорили, например, исследования, показавшие связь локусов эпигенетической модификации с воспалительными заболеваниями кишечника. Кроме того, было установлено, что микробиота регулирует организацию хроматина.
Ученые начали с того, что сравнили экспрессию генов в клетках эпителия крипт кишечника у мышей с нормальной микробиотой и вообще без нее. Анализ транскриптома показал заметные изменения: 824 гена экспрессировались сильнее и 358 слабее у мышей с нормальной микробиотой. Среди генов, чья экспрессия была выше, было много отвечающих за клеточное деление.
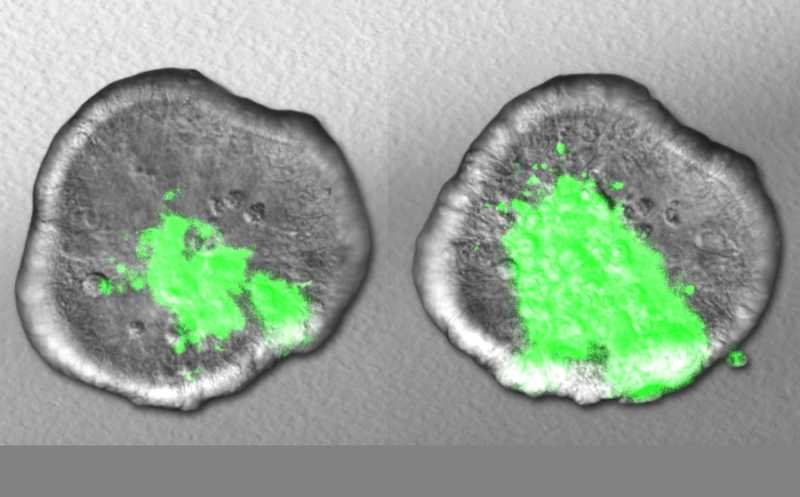
Затем авторы работы изучили разницу в метилировании эпителиальных клеток кишечника стерильных и контрольных мышей при помощи полногеномного секвенирования с обработкой бисульфитом натрия — этот метод позволяет отличить метилированные цитозины от неметилированных. Общий уровень метилирования у нормальных мышей оказался ниже: 12 983 регуляторных региона метилировались меньше, чем у мышей без микробиоты, и лишь 3 115 — больше.
Сравнение генов с различным уровнем экспрессии и регуляторных регионов с разным уровнем метилирования у двух групп мышей показало, что изменениям экспрессии в 554 случаях сопутствует уменьшение метилирования и в 154 случаях — увеличение. В 300 случаях гипометилирование привело к усилению экспрессии генов. Среди них обнаружились гены трех факторов транскрипции: FoxA, Eklf и AP1. Ученые предполагают, что эти факторы — проводники бактериальных сигналов в эпителий кишечника: FoxA и Eklf как раз отвечают за развитие и гомеостаз кишечника, а AP1 — за клеточную пролиферацию, дифференцировку, апоптоз и воспаление.
Изучение связи между воспалением и эпигенетикой показало, что индуцированное декстрансульфатом натрия воспаление кишечника приводит к уменьшению уровня метилирования у мышей с нормальной микробиотой. Среди гипометилированных генов присутствовали гены, отвечающие за хемотаксис иммунных клеток и воспалительный ответ. Увеличение экспрессии 373 генов совпало с гипометилированием их регуляторных последовательностей.
У стерильных мышей эффект эпигенетическая реакция на воспаление была выражена значительно слабее. Лишь 5% генов, чья экспрессия изменилась у мышей с нормальной микробиотой, изменили экспрессию без микробиоты, при этом только у 227 генов заметно менялись и экспрессия, и уровень метилирования.
Обычно за деметилирование ДНК отвечают ферменты ТЕТ. Ученые выяснили, что в клетках крипт кишечника экспрессируются варианты ТЕТ2 и ТЕТ3. Уровень экспрессии ТЕТ3 у мышей с нормальной микробиотой оказался выше, чем у стерильных. После приема антибиотиков уровень ТЕТ3 у мышей с микробиотой снизился до уровня мышей без нее. Мыши с нокаутированными ТЕТ2/3 в клетках кишечника имели заметно больший общий уровень метилирования, а экспрессия некоторых генов, соответственно, оказалась подавлена. Реакция на индуцированное воспаление кишечника у нокаутных мышей была выражена слабо — деметилирования регуляторных участков в них не произошло. Следовательно, микробиота управляет экспрессией генов через TET2/3.
Таким образом, ученые показали, что обитающие в ЖКТ бактерии с помощью эпигенетических механизмов меняют экспрессию генов в клетках кишечника при остром воспалении и тем самым поддерживают его гомеостаз.

 Меню
Меню





 Все темы
Все темы



 0
0