Почти 8% железистых клеток желудка накапливают ассоциированные с раком мутации к 60 годам
В Nature опубликован подробный анализ мутационного ландшафта клеток эпителия желудка. Его авторы сравнивают накопление мутаций и клональное размножение в нормальной и опухолевой железистой ткани. Согласно полученным данным, большинство желез желудка состоит преимущественно из потомков одной стволовой клетки, то есть представляет собой моноклональную структуру. У людей возрастом 60 лет около 8% клонов несут драйверные (ассоциированные с раком) мутации даже в отсутствие патологии. При раке желудка уровень моноклональности еще выше.
Мутационный ландшафт дает информацию о процессах накопления и отбора мутаций — как при нормальном старении, так и на ранних стадиях онкозаболеваний. До недавнего времени понимание ландшафта соматических мутаций ограничивалось именно раковыми клетками. Теперь же авторы статьи в Nature проанализировали мутации, связанные с траекториями развития нормальных и злокачественных клеток желудочного эпителия.
Исследователи провели полногеномное секвенирование 238 образцов нормальных и неопластических желез желудка. Медианное покрытие составило 23×, образцы были получены от 30 человек, у 18 из которых был рак желудка.
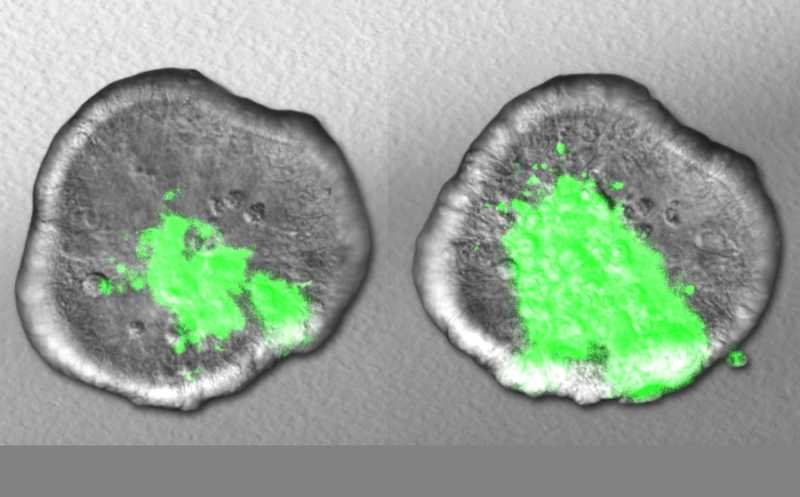
Желудочные железы состоят из разветвленных канальцев, ветвление которых могут поддерживать самообновляющиеся стволовые клетки. Предыдущие исследования показали, что, хотя желудочные железы закладываются как поликлональные структуры, со временем их состав смещается в сторону моноклональности. Оценка доли (или частоты) вариантных аллелей подтвердила, что в большинстве желез преобладает потомство единственной стволовой клетки. Лишь в 8% образцов обнаружилось четкое свидетельство сосуществования нескольких клонов и их потомков внутри одной железы.
У людей без патологий желудка общая мутационная нагрузка линейно увеличивалась с возрастом: стволовые клетки-предшественники в их железах накапливали около 27,8 однонуклеотидных вариантов (SNV) и 2,0 инделов в год. В железах людей с раком желудка в основном наблюдалась такая же скорость накопления мутаций, исключение составляли метапластические железы. Они встречались исключительно в антральном отделе желудка доноров с онкозаболеваниями. В метапластических железах накапливалось в среднем в 2,8 раза больше SNV и в 4,4 раза больше инделов, чем в нормальных железах за тот же промежуток времени. Также в них была выше доля потомков одной и той же стволовой клетки.
Опираясь на атласы соматических мутаций, исследователи определили девять мутационных сигнатур в анализируемых образцах. Характер этих сигнатур заметно отличался в железах опухолей или нормального желудка. Например, значительное количество мутаций SBS17a и SBS17b, характерных для аденокарциномы пищевода, аденокарциномы желудка и предракового состояния — пищевода Барретта — наблюдалось в этих образцах. В нормальном желудке эти мутационные сигнатуры встречались редко. Также в раковых образцах накапливались мутации SBS3 и ID6, связанные с нарушением гомологичной репарации, SBS2 и SBS13, ассоциированные с активностью APOBEC, и ID14 неустановленной природы.
Примечательным обнаружением стало количество трисомий в клетках желудочного эпителия, причем они зачастую несколько раз возникали независимо у одного и того же человека. Например, у 64-летнего мужчины с раком желудка в шести из 12 проанализированных желудочных желез наблюдалась трисомия по 20-й хромосоме, еще в трех — по 13-й, и в одной — потеря гетерозиготности на плече 17q хромосомы. Подобного не наблюдалось в других тканях, проанализированных в более ранних исследованиях — это позволяет предположить, что подобное свойственно только желудку.
Чтобы определить, какие гены подвергались положительному отбору, авторы отсеквенировали 321 известный ген, ассоциированный с раком, в 829 дополнительных образцах. Они выявили семь генов, несущих достоверные следы положительного отбора: ARID1A, ARID1B и ARID2 (субъединицы комплекса ремоделирования хроматина SWI/SNF); CTNNB1 (участник сигнального пути WNT и молекула клеточной адгезии); KDM6A (регулятор метилирования гистонов); LIPF (ген желудочной липазы) и EEF1A1 (фактор элонгации). Согласно литературным данным, большинство из них часто мутируют при раке желудка.
Доля клеток эпителия, состоящего из клонов с драйверными мутациями, определялась возрастом и тяжелым хронического воспаления, но не наличием метаплазии. В среднем у 60-летних людей около 7,8% желез были заняты преимущественно клонами клеток с драйверными мутациями. В пищеводе людей того же возраста из мутантных клонов состояло около 60% нормального плоскоклеточного эпителия, а в криптах тонкой и толстой кишки эта доля была гораздо ниже — около 1%.
Выявленные изменения в ландшафте соматических мутаций объясняют некоторые особенности самых ранних стадий неопластических изменений в желудке. При метаплазии, зачастую связанной с хроническим воспалением и локальной клональной экспансией, наблюдается увеличение общей мутационной нагрузки. Оно может отражать увеличение скорости деления клеток в метапластических железах или объясняться влиянием микроокружения, например, близлежащих очагов хронического воспаления.
Ноцицептивные нейроны стимулируют рост и метастазирование опухолей желудка
Источник
Coorens, T.H.H., et al. The somatic mutation landscape of normal gastric epithelium. // Nature (2025). DOI: 10.1038/s41586-025-08708-6


 Меню
Меню





 Все темы
Все темы



 0
0