Бета-клетки в упаковке из нановолокна дольше проживут в организме пациента с диабетом
Предложена новая конструкция импланта для лечения диабета 1 типа. Бета-клетки, полученные из индуцированных плюрипотентных стволовых клеток, растут в альгинатном геле, окруженном пористой пленкой из нановолокон. Гель и пористая мембрана защищают клетки от атак иммунной системы реципиента и в то же время не препятствуют выходу инсулина в кровь. Конструкция испытана на мышах и собаках.
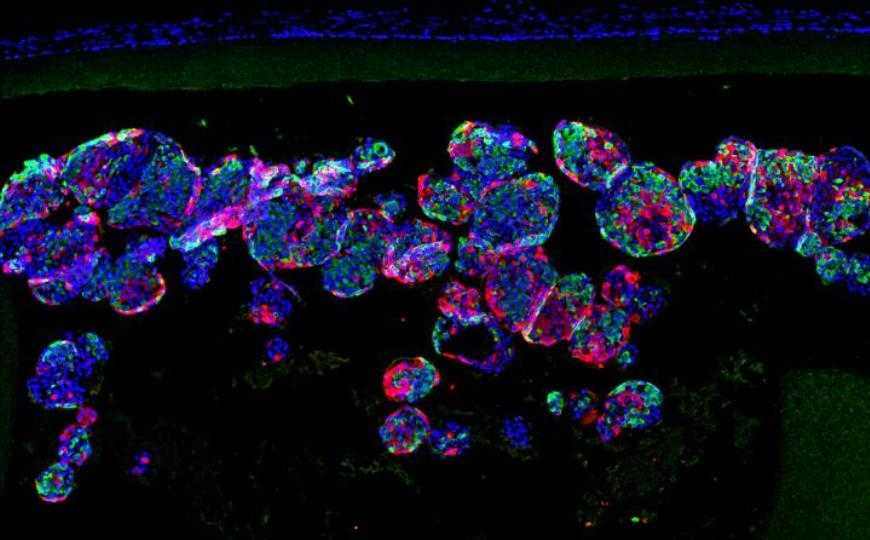
Инсулинсекретирующие клетки внутри импланта защищены от атак иммунной системы.
Credit:
Xi Wang | Пресс-релиз
С диагнозом «диабет» живут 7–10% населения мира, и заболеваемость растет. Определение содержания глюкозы в крови с помощью тест-полосок и даже непрерывный мониторинг этого параметра (подробнее на PCR.NEWS), а также возможность своевременного введения рекомбинантного инсулина обеспечивают больным приемлемое качество жизни. Но контроль уровней сахара и инсулина в крови требует концентрации внимания и педантичности, а если не сделать инъекцию своевременно, это может привести к опасному ухудшению состояния.
Продолжаются попытки имплантации клеток, секретирующих инсулин, пациентам с аутоиммунным диабетом 1 типа. Однако у таких пациентов в дополнение к аутоантителам и цитотоксическим Т-клеткам против инсулинсекретирующих бета- клеток поджелудочной железы — иммунной атаки, которая и стала причиной заболевания, — активируются реакции отторжения трансплантата. Статьи о трансплантации инсулинсекретирующих клеток от живых доноров или трупов публикуются с 2000 года, но даже при подавлении иммунной системы пациентов иммунодепрессантами реакция отторжения трансплантата рано или поздно развивается. Группе американских исследователей удалось существенно увеличить продолжительность жизни инсулинпродуцирующих клеток в организме реципиента, пока что в экспериментах на животных. Свою конструкцию импланта они назвали NICE (от nanofiber-integrated cell encapsulation).
Успеху способствовало сочетание трех технологических решений. Во-первых, авторы использовали бета-клетки, полученные дифференциацией из индуцированных плюрипотентных стволовых клеток (ИПСК). Трансплантация дифференцированных бета-клеток человека исключает риски применения стволовых клеток, связанные с онкотрансформацией. В то же время ранние этапы дифференцировки из ИПСК обеспечивают продолжительную репродукцию и жизнеспособность бета-клеток.
Во-вторых, бета-клетки росли в геле, то есть в трехмерном пространстве, а не на плоскости. Это обеспечивало сохранение активности генов «домашнего хозяйства».
В-третьих, клетки были окружены пленкой из нановолокон, проницаемой для питательных веществ и продуктов жизнедеятельности клеток, включая секретируемый инсулин, но не пропускающей клетки иммунной системы благодаря малому диаметру пор.
В эксперименте клетки человека окружали альгинатным гелем (полученным из водорослей и потому биосовместимым). Дополнительные преимущества альгинатных гелей — их высокая гидратация и замедление диффузии антител, что способствует защите клеток от иммунной системы реципиента. Гель, содержащий бета-клетки, помещали в трубочку из мягкого и прочного нановолокнистого пористого материала на основе силикона, поликарбоната и полиуретана. Затем устройства имплантировали экспериментальным животным — мышам с диабетом, а также здоровым собакам, чтобы продемонстрировать возможность масштабирования технологии для крупных млекопитающих. Сравнение различных способов введения микрокапсул показало преимущества внутрибрюшинной доставки.
Если имплант содержал бета-клетки мышей, эти клетки оставались функциональными и подавляли проявления диабета до 200 дней. Устройство также обеспечивало жизнеспособность человеческих бета-клеток и регуляцию уровня сахара в организме грызунов — до 120 дней у иммунодефицитных мышей и до 60 дней у иммунокомпетентных. Сходные результаты по сохранению жизнеспособности клеток авторы получили на гончих собаках.
Среди преимуществ разработки авторы отмечают простоту конструкции, а также «баланс безопасности и функциональности».
Источник
Wang, X. et al. // A nanofibrous encapsulation device for safe delivery of insulin-producing cells to treat type 1 diabetes. // Science Translational Medicine, 2021, 13 (596), eabb4601, DOI: 10.1126/scitranslmed.abb4601


 Меню
Меню





 Все темы
Все темы




 0
0








