CAR T-терапия предотвращает метаболическую дисфункцию у стареющих мышей
Перспективный метод борьбы с возрастными патологиями — сенолитическая CAR T-терапия, нацеленная на гликопротеин uPAR, который экспрессируют сенесцентные клетки. В новом исследовании показано, что такое лечение не только уменьшило количество uPAR-положительных клеток в разных тканях, но и улучшило метаболические показатели старых и молодых мышей. В организме молодых животных CAR T-клетки сохранялись более года после инфузии и оставались активными.
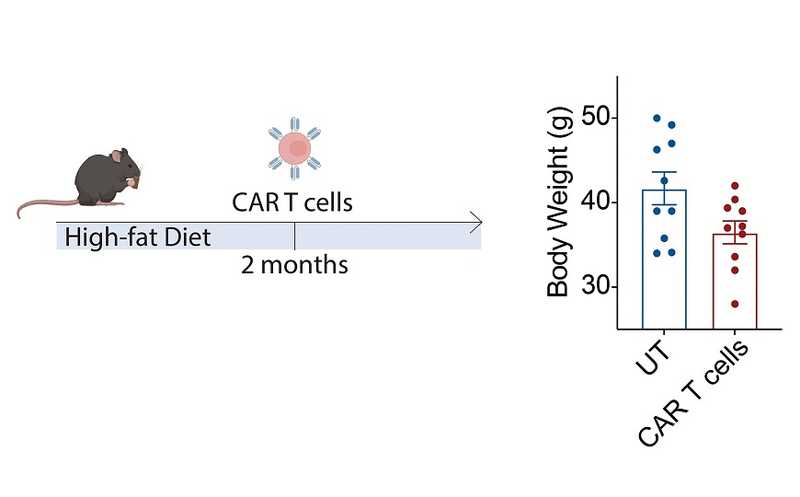
CAR T-клетки против маркера старения предотвратили ожирение у мышей на высококалорийной диете.
Credit:
Пресс-релиз | Nat Aging (2024). DOI: 10.1038/s43587-023-00560-5
В норме стареющие клетки уничтожаются клетками иммунной системы, но при старении организма этот процесс работает недостаточно хорошо, а накопление повреждений ускоряется. Для уничтожения сенесцентных клеток можно использовать сенолитические CAR T-клетки, нацеленные на рецептор урокиназы, активирующей плазминоген (uPAR). Этот белок активно экспрессируется на многих старых клетках и является важным компонентом SASP. Преимущества CAR T-клеток перед малыми молекулами-сенолитиками — понятный механизм действия, основанный на способности специфически распознавать единственный антиген стареющих клеток, и большая продолжительность действия после однократного введения.
Группа исследователей из Мемориального онкоцентра Слоуна — Кеттеринга, лаборатории Колд-Спринг-Харбор и других научных центров ранее установила, что CAR T-клетки против uPAR могут очищать от сенесцентных клеток организм молодых мышей и обращать вспять фиброз печени, вызванный химическими веществами или питанием. В новой работе они проверили, может ли uPAR служить мишенью для сенолитических CAR Т-клеток в старых тканях.
Прежде всего, авторы подтвердили, что доля uPAR-положительных клеток увеличивается с возрастом. Для этого они изучили данные РНК-секвенирования консорциума Tabula Muris Senis (атлас старения мышиных тканей) и убедились, что экспрессия гена Plaur, кодирующего uPAR, повышена в различных органах 20-месячных мышей по сравнению с 3-месячными. Увеличение количества белка подтвердили методами иммуногистохимии, а также собственными данными РНК-секвенирования единичных клеток, и выяснили, в каких популяциях клеток он преимущественно экспрессируется. Более того, многие сенесцентные клеток в тканях, идентифицированные с помощью других транскриптомных признаков, оказались uPAR-положительными (67–90% в печени, 92–66% в жировой ткани и 76–63% в поджелудочной железе).
Авторы также проанализировали доступные наборы данных о поджелудочной железе человека, сравнив данные для детей до 6 лет и людей старше 50. Фракция клеток, экспрессирующих PLAUR, у пожилых людей была существенно выше.
Затем исследователи ввели мышам линии C57BL/6 в возрасте 18–20 месяцев мышиные CAR Т-клетки, нацеленные на uPAR. Эти клетки были получены от мышей другой линии, что позволяло отличать их от собственных Т-клеток доноров. Для контроля неспецифической токсичности другим группам мышей вводили нетрансдуцированные Т-клетки либо мышиные CAR Т-клетки, нацеленные на человеческий CD19.
У мышей, получивших CAR Т-клетки против uPAR, но не в контроле, уменьшилось количество uPAR-положительных клеток во всех исследованных тканях, особенно в поджелудочной железе, печени и жировой ткани, а также снизились уровни провоспалительных цитокинов в плазме. Животные хорошо перенесли терапию, у них не наблюдалось патологии тканей или изменения функциональных параметров печени и почек.
Интересным результатом оказалась нормализация гомеостаза глюкозы и других метаболических показателей у мышей, получивших терапию. У них снизился уровень глюкозы натощак по сравнению с контролем. Когда им ввели глюкозу внутрибрюшинно (2г на кг массы тела), у пожилых мышей после CAR Т-терапии глюкоза также была ниже, чем у контрольной группы, при этом у молодых животных эффекта не наблюдалось. Через 2,5 месяцев после лечения такие мыши лучше переносили физические нагрузки, чем ровесники.
Улучшение метаболической функцией сопровождалось размножением CAR Т-клеток и их экспансией в некоторые органы, в том числе в печень и селезенку. У контрольных групп, получивших Т-клетки, не нацеленные на uPAR, этого не происходило.
Но, возможно, самым поразительным наблюдением стала способность CAR Т-клеток против uPAR действовать профилактически, приостанавливая дисфункцию метаболизма, вызванную возрастом и диетой.
CAR T-клетки могут сохраняться в организме долгое время после инфузии (у человека до 10 лет). Авторы ввели сенолитические клетки трехмесячным мышам и убедились, что через 12 месяцев их уровень остается высоким — вероятно, из-за постоянной стимуляции антигеном, так как количество таргетных uPAR-положительных клеток в организме увеличивается с течением времени. И у таких мышей тоже было смягчено развитие возрастных патологий метаболизма, то есть раннее введение клеток работало как «профилактика старения». Метаболическая дисфункция, вызванная богатой жирами диетой, у них была менее выраженной, даже если из два месяца держали на такой диете и только потом вводили CAR T-клетки.
«Если мы дадим [терапию] старым мышам, они омолаживаются. Если мы дадим ее молодым мышам, они стареют медленнее. Никакая другая терапия на данный момент не может этого сделать», — говорит первый автор статьи, Корина Амор Вегас из Колд-Спринг-Харбор.
Авторы отметили, что их данных недостаточно, чтобы сделать выводы о влиянии сенолитической CAR T-терапии на продолжительность жизни. Еще предстоит определить, удаление каких именно популяций uPAR-положительных клеток обеспечивает улучшение метаболической функции; авторы с сожалением отмечают, что бета-клетки поджелудочной железы им проверить на корреляцию старения с экспрессией uPAR не удалось.
Источники
Amor, C., et al. Prophylactic and long-lasting efficacy of senolytic CAR T cells against age-related metabolic dysfunction // Nature Aging (2024). DOI: 10.1038/s43587-023-00560-5
Цитата по пресс-релизу


 Меню
Меню





 Все темы
Все темы




 0
0