Частота замен G–U в геноме коронавируса выросла в 9 раз, когда он начал заражать людей
Александр Панчин и Юрий Панчин (Институт проблем передачи информации им. А.А.Харкевича РАН) исследовали накопление мутаций в геноме коронавируса SARS-CoV-2 до и после того, как он начал распространяться среди людей. Оказалось, что частота одной определенной нуклеотидной замены — G на U — резко выросла, когда вирус стал передаваться от человека к человеку.
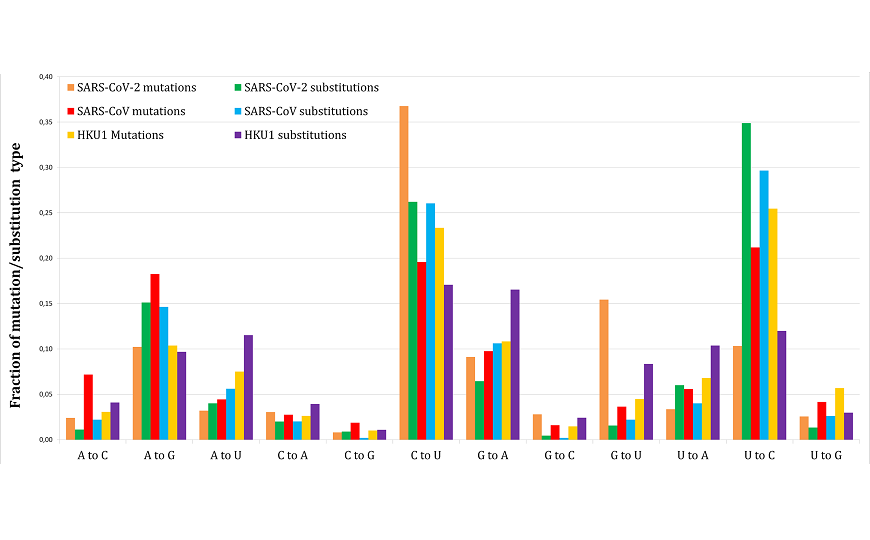
Доли различных нуклеотидных замен в геномах вирусов, перешедших к человеку от других хозяев, после перехода и до него. Доля замен G на U в геноме SARS-CoV-2 при переходе к человеку выросла необычно резко (оранжевый столбик по сравнению с зеленым)
Credit:
PeerJ 8:e9648, DOI: 10.7717/peerj.9648/fig-1 | CC 4.0
Как влияет на эволюцию вируса смена хозяина? Чтобы ответить на этот вопрос, авторы работы взяли около тысячи полностью прочитанных геномов SARS-CoV-2 и определили относительные частоты уникальных одиночных мутаций, то есть отличий от консенсусной последовательности генома вируса. Результаты сопоставили с заменами одиночных нуклеотидов, которые произошли в геноме SARS-CoV-2 по сравнению с геномом общего предка нового коронавируса и родственных вирусов летучих мышей (предковый геном можно реконструировать биоинформатическими методами). Эти замены должны были произойти на отрезке эволюционного пути вируса до перехода к новому хозяину — человеку. Аналогичные расчеты выполнили для двух других коронавирусов, которых люди получили от животных: вируса атипичной пневмонии (SARS-CoV) и коронавируса HKU1.
Чтобы избежать путаницы, исследователи в тексте статьи называют «мутациями» однонуклеотидные отличия первого типа, те, которые произошли после того, как вирус перешел к человеку, а «заменами» — отличия от предкового генома, возникшие до этого события.
«После перехода к человеку у SARS-CoV-2 происходит удивительная вещь: примерно в десять раз увеличивается доля мутаций G в U, — пишет Александр Панчин у себя в блоге. — Причем такого эффекта не наблюдается для SARS-CoV или HKU1. Сначала мы думали, что это может быть ошибкой, но оказалось, что результат воспроизводится независимо от того, каким методом читались геномы (Ion Torrent или Oxford Nanopore. — PCR.news), используем ли мы геномы из США или Китая, надежности мутационных данных и так далее».
Интересно тут именно изменение частоты встречаемости мутации после перехода к человеку. Например, мутаций С–U у SARS-CoV-2, персистирующего в человеческой популяции, тоже много. Но доля замен С-U была высокой и до перехода к человеку.
При этом относительные количества нуклеотидных замен разного типа в ранней эволюционной истории SARS-CoV-2, до заражения людей, похожи на аналогичные показатели у SARS-CoV и HKU1. Это хорошо согласуется с работами, указывающими на естественное происхождение вируса, отмечают авторы.
Возникает вопрос: в чем может быть причина ускоренного накопления замен одного типа? Естественно предположить, что ферменты, копирующие РНК, начали делать больше ошибок, попав в новую среду — человеческую клетку. Однако число комплементарных мутаций C в А не увеличилось. Геном SARS-CoV-2 представлен положительной (кодирующей белки) цепочкой РНК. Когда вирус заражает клетку, (+)-цепь используется для синтеза (-)-цепей, на которых в свою очередь синтезируются новые (+)-цепи, упаковываются в вирусные оболочки и покидают клетку. Нуклеотидам A, U, G, C на (+) цепи соответствуют нуклеотиды U,A,C,G на (-)-цепи. Если бы избыток мутаций G–U возникал за счет ошибок копирования РНК, то такие ошибки, вероятно, возникали бы при копировании как положительных, так и отрицательных цепей. Должен был наблюдаться также избыток С–А, но этого нет.
Авторы предложили объяснение, подчеркнув его гипотетический характер: действие окислительного стресса в человеческих клетках. Есть данные в пользу того, что летучие мыши, прежние хозяева вируса, выработали механизмы устойчивости к окислительному стрессу. Возможно, в этом одна из причин их способности легко переносить вирусные заболевания, опасные для других животных. Тогда человеческая клетка оказалась для вируса более агрессивной средой.
Окислительный стресс приводит к избытку мутаций G в Т в ДНК, за счет превращения G в 8-оксигуанины. В нормальной ДНК при синтезе новой цепи напротив G ставится C, но напротив 8-оксигуанинов могут ставиться как C, так и А. Затем напротив А ставится Т, а это и значит, что исходное G поменялось на Т. Есть работы, показывающие, что 8-оксигуанины могут аналогичным образом вносить ошибки при синтезе РНК, причем происходит замена G–U. (Как известно, в РНК тимины заменены на урацилы).
«Представим, что на поздних этапах заражения клеток человека возникает как пик синтеза положительных цепей SARS-CoV-2, так и пик окислительного стресса, ведущего к высокому содержанию 8-оксигуанинов в РНК. Именно положительные цепи, обогащенные 8-оксигуанином, передадутся следующим клеткам. Отрицательные цепи, даже если они тоже обогатятся 8-оксигуанином, никуда не передадутся. Поэтому мы увидим только то, как на положительных цепях G заменяется на U, — объясняет Александр Панчин. — Но я еще раз повторю, что это только гипотеза. Кроме того, нас удивляет, что мы не видим такого же эффекта в случае с вирусом атипичной пневмонии».
Мы задали Александру Панчину еще один вопрос.
— А что насчет других вариантов мутаций/замен, которые вы рассматривали? Среди них нет таких, что вызываются окислительным стрессом?
— Классическая связка окислительного стресса — с мутациями 8-оксигуанин, хотя мы чего-то можем не знать. У других классов мутаций другие могут быть причины. Например, мы ссылается на пару работ, где отмечают роль некоторых белков в мутагенезе коронавируса и других вирусов. Эти факторы, кстати, на мутагенез влияют сильно.
Источник
Panchin AY, Panchin YV. 2020. Excessive G–U transversions in novel allele variants in SARS-CoV-2 genomes. PeerJ 8:e9648; DOI: 10.7717/peerj.9648


 Меню
Меню





 Все темы
Все темы




 0
0








