CRISPR-терапия наследственной слепоты прошла фазу 1/2 КИ
Мутации в гене CEP290 (кодирует центросомальный белок) вызывают врожденный амавроз Лебера, при котором нарушаются функции фоторецепторов. Потеря зрения наступает в первые 10 лет жизни. Компания Editas Medicine совместно с учеными из США провела клинические испытания фазы 1/2 CRISPR-Cas9-препарата EDIT-101, вырезающего сломанный участок CEP290. У 11 из 14 (79%) пациентов наблюдалось улучшение хотя бы одного показателя, которое сохранялось с течением времени. Улучшение остроты зрения с коррекцией зафиксировали у девяти (64%) пациентов. Результаты подтверждают безопасность лечения и доказывают возможность эффективной генной терапии этого заболевания с помощью CRISPR-Cas9.
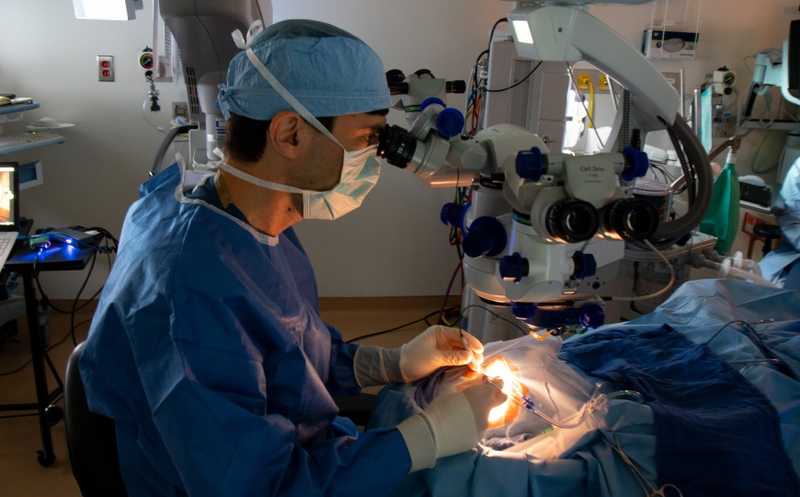
Доктор Джейсон Командер проводит операцию по введению CRISPR-Cas9-препарат в глаз пациента.
Credit:
Mass Eye and Ear |
пресс-релиз
Наследственная дегенерация сетчатки — группа заболеваний с менделевским наследованием, одна из основных причин слепоты в мире. Патогенные варианты более чем в 280 генах вызывают дисфункцию и гибель фоторецепторов сетчатки, что неизбежно ведет к нарушению и потери зрения. Ген CEP290 кодирует одноименный центросомальный белок, необходимый для формирования и правильного функционирования ресничек (в том числе ресничек фоторецепторов). При мутациях в этом гене развивается врожденный амавроз Лебера — слепота при нем наступает в течение первых десяти лет жизни. Самой распространенной мутацией считается однонуклеотидная замена в 26-ом интроне CEP290 (вариант IVS26). В США она встречается у 77% пациентов. Для наследственной дегенерации сетчатки нет лечения, ученые и врачи могут предложить только поддерживающую терапию и комфортную среду. Компания Editas Medicine (в числе основателей — Фэн Чжан и Джордж Черч) предлагает использовать CRISPR-Cas9-конструкт EDIT-101, удаляющий IVS26 навсегда. Ранее ученые делились промежуточными результатами клинических испытаний. Теперь же результаты исследований опубликованы в В New England Journal of Medicine.
В исследовании приняло участие 14 человек: 12 взрослых (17–63 года, 36% мужчин) и двое детей (9 и 14 лет). У большинства участников была сильная потеря остроты зрения (<1,6 logMAR — логарифма минимального угла разрешения) и чувствительности к красному свету. Препарат вводили в глаз с худшим зрением при задней витрэктомии (прокол стекловидного тела и ввод хирургических инструментов для лучшего доступа к сетчатке). Ученые сформировали четыре группы. Первая получила 6×1011 векторных геномов на мл, вторая 1×1012 в.г./мл, третья 3×1012 в.г./мл, четвертая (дети) получила среднюю (1×1012 в.г./мл) дозу. Участникам субретинально вводили по 300 мкл препарата. На февраль 2023 года медиана времени наблюдения составила 376 дней.
Серьезных побочных эффектов, вызванных лечением, не зафиксировали. Большинство случаев были легкой (76%) или умеренной (22%) степени тяжести, только 41% из них относился к лечению. Всего зафиксировано 22 нежелательные реакции на лечение. У двух пациентов ухудшилось зрение, у одного из них это было вызвано кровоизлиянием в стекловидное тело после операции. У участников, получивших высокую дозу, наблюдалось увеличение субретинальной неоваскулярной мембраны. Состояние улучшилось после лечения глюкокортикоидами. У двух других пациентов наблюдали пигментную эпителиопатию сетчатки в области инъекции, но она не затронула функцию фоторецепторов или зрение. Вирусные геномы были обнаружены в слезной жидкости (у 93% участников), слизистой оболочке носа (29%) и крови (36%). К третьему месяцу вирусные геномы перестали детектироваться.
Улучшение остроты зрения зафиксировали у девяти (64%) пациентов. У четырех участников (29%) оно достигло клинически значимых показателей — не менее 0,3 logMAR. У троих из них ответ на терапию увидели только через три месяца. Примечательно, что в контрольном глазу, куда не вводили препарат, также наблюдалось временное улучшение остроты зрения. У шести пациентов (43%) порог чувствительности сетчатки к свету (оценка функций колбочек) повысился минимум на 0,6 log кд*сек/м2 — это считается значимым улучшением зрительного порога чувствительности. В контрольном глазу значимых изменений не отмечалось. У всех, кто получил высокую дозу EDIT-101, наблюдали умеренную положительную корреляцию между изменением остроты зрения и изменением порога чувствительности в ответ на стимуляцию красным светом. Ориентирование на дистанции значимо улучшилось у 4 из 14 (29%) участников. О возросшем качестве жизни сообщили шесть пациентов (43%). В целом, у 79% участников наблюдалось улучшение хотя бы по одному из четырех показателей, а у 43% улучшилось два и более.
Авторы заключают, что препарат безопасен. Побочные реакции были ожидаемы при проводимых процедурах, однако требуется более длительное наблюдение за возможными нецелевыми эффектами редактирования генома.
Источник
Eric A. Pierce et al. Gene Editing for CEP290-Associated Retinal Degeneration. // New England Journal of Medicine, 2024. May 6, 2024. DOI: 10.1056/NEJMoa2309915


 Меню
Меню





 Все темы
Все темы



 0
0