Cтруктура нативного LAG3 определена с помощью новой технологии — универсального фидуциарного маркера
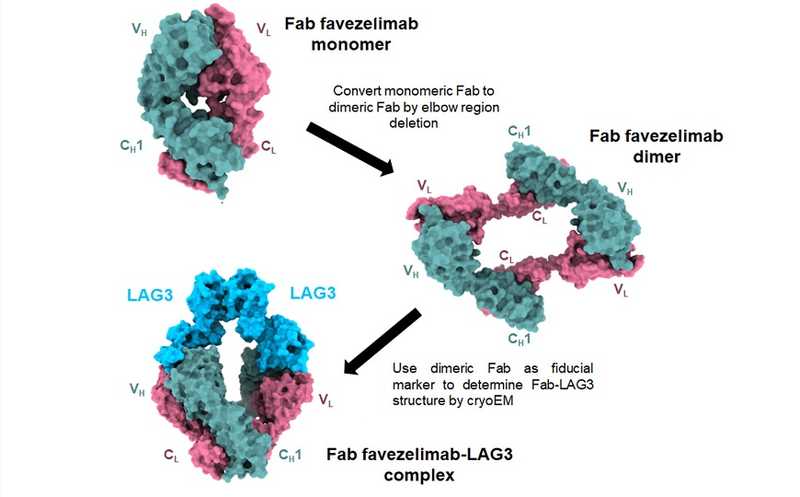
Исследователи из Университета Мэриленда разрешили структуру нативного LAG3, одного из рецепторов контрольных точек иммунитета, инактивирующего противоопухолевый Т-клеточный ответ. Так как молекулярный вес LAG3 слишком мал для анализа с помощью криоЭМ, его исследовали в комплексе с антителом-антагонистом — фавезелимабом. Был сконструирован лиганд особого строения — димер Fab-фрагмента фавезелимаба, имеющий характерную форму и высокую жесткость.
Клеточный рецептор LAG3 — перспективная мишень для противоопухолевой терапии. Антитела-антагонисты, блокирующие связывание LAG3 с лигандами, снижают активность регуляторных Т-клеток так же, как известные ингибиторы контрольных точек иммунитета к паре PD-1/PD-1L. Это приводит к активации противоопухолевого Т-клеточного ответа и уничтожению опухолевых клеток, несущих неоантигены. Нативный LAG3 оказалось невозможно кристаллизовать: с момента его открытия на протяжении более 10 лет это не удалось никому. Между тем получение и анализ структур LAG3 в комплексе с антителами-антагонистами и лигандами играет важнейшую роль в разработке и оптимизации новых технологий иммунотерапии рака. Исследователи из Университета Мэриленда впервые получили данные о структуре нативного LAG3 в комплексе с антителом-антагонистом, используя криоэлектронную микроскопию.
Ранее другой исследовательской группе удалось получить кристаллы LAG3 и изучить их структуру. Однако в этой работе использован суррогатный LAG3 — белок, содержащий мутации, которые были получены комбинаторными методами. Получение структуры нативного LAG3 оставалось крайне важным, особенно учитывая жесткие рамки современной фармакологии.
Криоэлектронная микроскопия (криоЭМ) — относительно новый метод исследования структуры макромолекул, который изначально был разработан для изучения сложных макромолекулярных комплексов, например вирусов, небольших клеточных органелл, мембранных белковых комплексов и т.п. В отличие от стандартной методики рентгеноструктурного анализа криоЭМ не требует получения совершенных кристаллов макромолекул, способных к дифракции рентгеновских волн на уровне, сравнимом с длиной химической связи (1,5–2,5 ангстрема). Именно поэтому с помощью криоЭМ было исследовано значительное количество биологических структур, кристаллизация которых затруднена или вообще невозможна. Тем не менее криоЭМ имеет достаточно жесткие ограничения по нижнему пределу молекулярного веса: мишени менее 100 КДа не удается изучать этим методом, несмотря на значительный прогресс в развитии оборудования и программного обеспечения.
Для компенсации молекулярного веса и облегчения анализа структуры малых биомолекул было предложено использовать опорные, или фидуциарные маркеры — молекулы с известной или легко разрешаемой структурой, способные связываться с мишенью. Наиболее удобные маркеры — Fab-фрагменты антител. Однако массы моновалентного Fab недостаточно в случае LAG3 и других молекул аналогичного размера. Многие типы Fab подвижны и легко диссоциируют, что затрудняет анализ результатов. Более того, поскольку значительная часть клеточных рецепторов, в том числе LAG3, относятся к суперсемейству иммуноглобулинов, структуры моновалентного Fab и LAG3, полученные с помощью криоЭМ, сложно отличить при предварительном анализе.
Ранее группа из Университета Мэриленда сконструировала антитела, содержащие одинарные или двойные делеции остатков серина и/или аланина в зоне сочленения вариабельного и константного доменов VH и CH1 тяжелых цепей в составе Fab-фрагмента антитела. Такие мутанты образуют димер Fab-фрагментов. Эта структура, помимо высокой жесткости, имеет весьма характерную кольцевую форму, которая существенно облегчает отбор индивидуальных комплексов антитело-LAG3 для компьютерного разрешения молекулярной структуры.
Таким образом, исследователям удалось не только разрешить структуру нативного LAG3 в комплексе с антителом фавезелимабом, но и создать универсальный фидуциарный маркер для криоЭМ, который делает возможным разрешение структур практических любых белков малого размера.
О том, чем замечателен фавезелимаб и на какой стадии находятся его клинические исследования, мы спросили участника работы Александра Колесникова (Институт биологических и биотехнологических исследований UMD и NIST; в настоящее время — сотрудник биотехнологической компании KeyGene USA).
«Наиболее продвинутое исследование начинается сейчас — третья фаза в комбинации с пембролизумабом (Кеytruda). Кроме того, что ряд предыдущих клинических испытаний показал хорошие результаты такой комбинированной терапии метастатического рака прямой кишки, не реагирующего на стандартную терапию, что-то специфически выдающееся именно для фавезелимаба придумать трудно. Ho cпектр опухолей, реагирующих на такую комбинированную терапию, может оказаться весьма широким, и тогда это действительно будет выдающимся свойством фавезелимаба, — комментирует Александр Колесников. — Но это еще нужно доказать. Из нашей работы стало понятно, что фавезелимаб очень эффективно блокирует взаимодействие LAG3 с основным лигандом — MHC класса II».
Рецептор KIR3DL3 оказался потенциальной контрольной точкой иммунитета
Источник
Arjun K Mishra, et al. CryoEM structure of a therapeutic antibody (favezelimab) bound to human LAG3 determined using a bivalent Fab as a fiducial marker. Structure. 2023 Aug 10; S0969-2126(23)00277-0. DOI: 10.1016/j.str.2023.07.013


 Меню
Меню





 Все темы
Все темы




 0
0








