Действие антикоагулянта, вдохновленного кровососущими животными, можно обратить вспять
Кровососущие животные вырабатывают разжижающие кровь соединения — пептидные ингибиторы тромбина и других протеаз, участвующих в свертывании крови. Эти ингибиторы способны связываться с протеазами в еще одном сайте, помимо активного. Вдохновившись этим, ученые из США представили новый класс антикоагулянтов EXACT: малая молекула, связывающаяся с активным сайтом протеазы, и конъюгированный с ней аптамер, связывающийся с экзосайтом. Эффективность подавления тромбина у такой молекулы была более чем в 500 раз выше, чем у ее компонентов по отдельности. При этом действие антикоагулянта можно быстро обратить вспять с помощью олигонуклеотидного антидота.
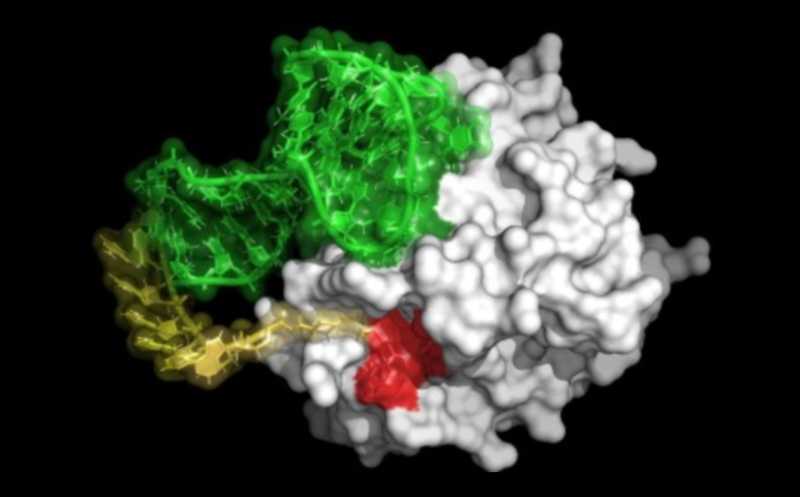
Кровососущие насекомые и другие животные вырабатывают антикоагулянты — пептидные ингибиторы участвующих в свертывании крови протеаз, которые чаще всего связываются с ними в активном сайте и в экзосайте. Примером такого ингибитора служит гирудин, вырабатываемый пиявками и связывающийся с активным сайтом и экзосайтом тромбина. Вдохновившись такими природными бивалентными ингибиторами, ученые из США разработали ингибиторы тромбина и фактора Xa EXACT. Они состоят из малой молекулы, связывающейся с активным сайтом протеазы, и аптамера, связывающегося с ее экзосайтом.
Исследователи подошли к разработке нового антикоагулянта с точки зрения рационального дизайна. Они получили конъюгат из дабигатрана (DAB) — малой молекулы, которая ингибирует тромбин, — и ДНК-аптамера HD22, связывающегося с экзосайтом ABE2 тромбина. Между собой эти компоненты связали с помощью линкера из одноцепочечной ДНК. Далее исследователи определили концентрацию полумаксимального ингибирования (IC50) для получившегося вещества, проверили различные клинически важные показатели антикоагулянта и разработали антидот, обращающий его действие вспять.
Авторы работы получили антикоагулянт HD22-7A-DAB — аптамер и дабигатран в нем соединены линкером из семи нуклеотидов. Компоненты в составе антикоагулянта проявили синергическое действие. IC50 дабигатрана составила 50 нМ; для HD22 эта концентрация составила 0,95 нМ, хотя при этом аптамер мог подавлять максимум 30% активности тромбина. HD22-7A-DAB, напротив, имел IC50, равную 0,1 нМ и мог подавлять больше 99% активности тромбина при концентрации 1 нМ. Таким образом, конъюгат оказался в 500 раз эффективнее дабигатрана. Синергический эффект ученые объяснили через термодинамику. Сначала либо аптамер, либо малая молекула, входящие в состав антикоагулянта, связываются с протеазой с константой диссоциации, схожей с константой свободного аптамера или малой молекулы. Благодаря этому второй компонент антикоагулянта оказывается вблизи своего сайта связывания. Далее происходит мономолекулярный процесс, который независим от концентрации ингибитора, поэтому антикоагулянт эффективно подавляет активность тромбина даже при низких концентрациях.
При этом на действие антикоагулянта влияет длина олигонуклеотидного линкера между аптамером и малой молекулой. Она должна быть равна хотя бы расстоянию между активным сайтом и экзосайтом протеазы. Если линкер слишком короткий, то он препятствует связыванию молекулы с обоими сайтами протеазы и таким образом снижает эффективность ингибирования. В данном случае оптимальная длина линкера составила 7 нуклеотидов (длина — 49 Å), но ее увеличение вплоть до 30 нуклеотидов (длина — 18,5 нм) не изменило IC50 и другие показатели.
Исследователи также показали, что, заменив аптамер, можно отрегулировать селективность антикоагулянта. Дабигатран способен связываться не только с тромбином, но и с фактором Xa, хотя аффинность такого связывания слабее более чем в 800 раз. Ученые конъюгировали дабигатран с РНК-аптамером 11F7t через линкер из 20 нуклеотидов и получили еще один ингибитор семейства EXACT — 11F7t-20A-DAB. Исследователи наблюдали тот же синергический эффект в подавлении активности фактора Xa. IC50 свободного дабигатрана превышала 500 нМ, аптамер 11F7t также не ингибировал фактор Xa. Однако IC50 для молекулы 11F7t-20A-DAB составила 0,18 нМ, т. е. она была эффективнее свободного дабигатрана более чем в 2500 раз. В то же время такая молекула не способна ингибировать тромбин: замена аптамера действительно помогла изменить селективность препарата.
Чтобы обратить действие антикоагулянта, ученые разработали антидот — олигонуклеотиды, которые комплементарно связываются с линкером или аптамером. Антидот, который связывался со всей длиной аптамера и линкера, снижал эффективность действия антикоагулянта HD22-7A-DAB более чем в 10 тысяч раз. Механизм действия антидота состоит в том, что, связываясь с аптамером, он нарушает его связывание с экзосайтом, а также снижает гибкость линкера, образуя двухцепочечную ДНК.
Далее исследователи более подробно охарактеризовали влияние молекулы HD22-7A-DAB на тромбин. Они оценили способность тромбина к разрезанию фибриногена с помощью турбидиметрии: сам по себе тромбин может свободно разрезать фибриноген, что приводит к образованию фибриновых сгустков и повышению оптической плотности. При действии дабигатрана образование фибриновых сгустков замедлялось на 7,7 минут, также снижалась сама скорость образования сгустков и максимальная оптическая плотность. HD22 вообще не подавлял тромбин в этом тесте, так как он связывается с экзосайтом и не может влиять на взаимодействие между тромбином и фибриногеном. В присутствии 50 нМ HD22-7A-DAB фибриновые сгустки вообще не образовывались в течении времени всего эксперимента — 120 мин, то есть эта молекула практически полностью подавляла активность тромбина. Если через 10 минут после добавления антикоагулянта в раствор также вносили антидот, то еще через 9,8 минут оптическая плотность раствора начинала быстро расти, что свидетельствовало об образовании фибриновых сгустков.
Ученые также оценили клинически важные показатели антикоагулянта. Используя плазму крови человека, они определили тромбиновое время (ТВ) — параметр, отражающий скорость превращения фибриногена в фибрин под действием тромбина. HD22 никак не повлиял на ТВ, для дабигатрана в концентрации 250 нМ оно составило 518 сек, а для HD22-7A-DAB в концентрации 31 нМ, превышающей концентрацию тромбина, ТВ превысило 999 с. При этом действие антикоагулянта удавалось обратить вспять практически полностью всего за 5 минут с помощью антидота. Протромбиновое время (ПТВ) и активированное частичное тромбопластиновое время (АЧТВ) — это показатели, которые отражают активацию внешнего и внутреннего путей свертывания крови. HD22-7A-DAB значительно продлевал и ПТВ, и АЧТВ в концентрации 500 нМ, и его эффект также можно было прекратить с помощью антидота. При этом ученые отметили, что разработанный ими антикоагулянт не может полностью предотвратить свертывание крови, так как никак не влияет на активацию тромбина фактором Xa. Из-за этого эффективность антикоагулянта будет падать, если концентрация тромбина превысит его концентрацию.
В сравнении с гепарином — наиболее часто применяющимся в клинике антикоагулянтом — HD22-7A-DAB эффективнее продлевал ТВ и ПТВ из-за того, что он лучше связывается с тромбином. Однако гепарин лучше продевал АЧТВ, что связано с его способностью ингибировать не только тромбин, но и факторы Xa и IXa.
Действие разработанного антикоагулянта также проверили на цельной крови человека, чтобы определить активированное время свертывания крови — параметр, который отслеживается при различных инвазивных процедурах, требующих быстрого и системного антикоагулирующего действия. HD22-7A-DAB продлевал активированное время свертывания до 624 с при концентрации 1 мкМ, причем делал это лучше, чем гепарин.
Таким образом, исследователи предложили новый класс антикоагулянтов EXACT, которые могут обратимо подавлять действие протеаз, участвующих в свертывании крови. Аптамеры обеспечивают более высокую аффинность связывания с протеазами и селективность к конкретным из них, за счет этого повышая эффективность малых молекул.


 Меню
Меню





 Все темы
Все темы




 0
0








