Динамику ответа на коронавирусную инфекцию у людей изучили на уровне единичных клеток
Международный коллектив исследователей подробно изучил динамику клеточного ответа на SARS-CoV-2. Для этого здоровым добровольцам интраназально вводили вирус, после чего анализировали изменения иммунных клеток в крови и в эпителии носоглотки. Всего ученые выделили три подтипа инфекции, каждый из которых характеризовался своей динамикой и особенностями клеточных реакций. У части испытуемых инфекция не развилась, хотя иммунная система этих людей реагировала на вирус. Авторы работы связывают это с повышенной экспрессией одного из вариантов MHC класса II — HLA-DQA2 — в клетках иммунной системы.
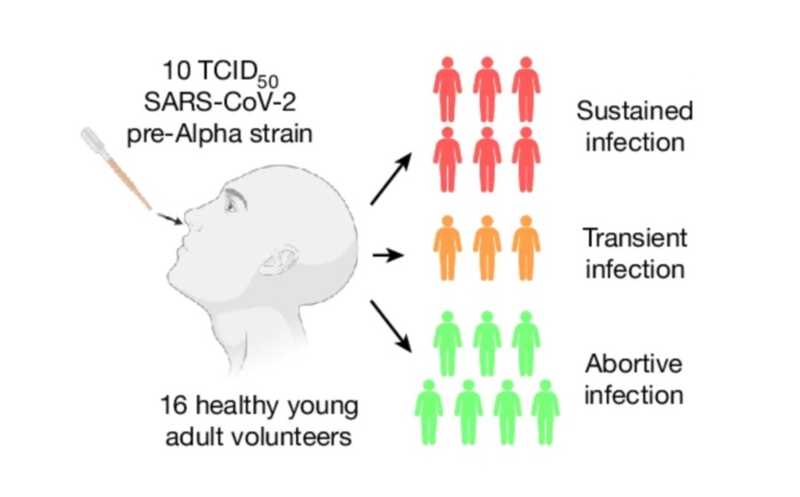
16 добровольцев, инфицированных SARS-CoV-2, разделили на три типа инфекции в зависимости от динамики ее протекания.
Credit:
Nature (2024). DOI:
10.1038/s41586-024-07575-x |
CC BY
Пандемия COVID-19 остается глобальной проблемой здравоохранения, однако понимание динамики раннего клеточного ответа на инфицирование этим вирусом остается ограниченным. Коллектив под руководством ученых из Великобритании провел мультиомиксное профилирование крови и мазков из носоглотки людей, зараженных SARS-CoV-2, чтобы разобраться во временных паттернах инфекции и ответа на нее на уровне единичных клеток.
Чтобы изучить реакцию эпителиальных и иммунных клеток на SARS-CoV-2, исследователи пригласили 16 добровольцев, которых интраназально инокулировали диким типом пре-альфа штамма SARS-CoV-2. Перед началом исследования испытуемые проходили тщательное обследование, чтобы исключить риск развития тяжелой формы инфекции и устранить влияние сопутствующих заболеваний. Серьезных нежелательных явлений не наблюдалось, и все симптомы были в итоге устранены у участников исследования.
У шести участников развилась устойчивая инфекция, подтвержденная минимум двумя последовательными ПЦР-тестами и симптомами. У трех человек в период с 1,5 по 7 сутки после инокуляции результаты ПЦР на вирусную нагрузку были единичными или погранично-положительными. Это не соответствовало ранее установленным критериям устойчивой инфекции, поэтому их отнесли к особой группе транзиторной инфекции, и факторы, ассоциированные с этим фенотипом, изучали отдельно. Еще семь человек были отнесены к группе абортивной инфекции, поскольку показывали только отрицательные результаты ПЦР в ходе исследования, однако у них наблюдалась ранняя реакция врожденного иммунитета.
Авторы работы провели секвенирование РНК единичных клеток, секвенирование Т-клеточныхТ-клеточных (TCR) и B-клеточных (BCR) рецепторов в семи временных точках, начиная со дня до инокуляции. Также они получили протеомные профили периферических мононуклеарных клеток крови (PBMC). Анализ иммунного ландшафта показал, что все типы иммунных клеток инфильтрировали место инокуляции, однако при устойчивых инфекциях инфильтрация начиналась только на пятый день и увеличивалась до десятого, а при транзиторных начиналась сразу, а затем снижалась. Наконец, в группе абортивной инфекции инфильтрация была незначительной, но включала привлечение CD4+ и CD8+ T-клеток на первый день.
Анализ экспрессии противовирусных генов показал, что у участников с устойчивой инфекцией активировался интерфероновый ответ. Активация интерферонового сигналинга наблюдалась как в клетках крови, так и в эпителии носоглотки, причем некоторые типы клеток полностью переключались на фенотип активации интерфероном. Это происходило с лимфоидными клетками врожденного иммунитета на третий день инфекции, а с γδ Т-клетками, инфильтрирующими носоглотку — на пятый. При абортивных и транзиторных инфекциях активации интерферонового ответа не наблюдалось.
При устойчивой инфекции снижалось количество циркулирующих и населяющих носоглотку миелоидных клеток на третий день, однако их количество локально возрастало в месте инокуляции. Также во всех группах снижался уровень провоспалительных моноцитов. На этом же сроке инвариантные Т-клетки, ассоциированные со слизистыми оболочками (MAIT) активировались при устойчивой инфекции, аналогичный эффект наблюдался при транзиторной и абортивной инфекциях. Авторы предположили, что как MAIT, так и провоспалительные моноциты могут играть ключевую роль в немедленном ответе на инфекцию SARS-CoV-2.
Оценка вирусной нагрузки выявила пик содержания РНК вируса на седьмой день инфекции. Большое количество SARS-CoV-2 детектировалось в CD8+ T-лимфоцитах, несмотря на отсутствие у них ACE2 и TMPRSS2. Впрочем, отмечают авторы, инфицирование Т-клеток уже наблюдалось in vitro и в тканях легких человека. Кроме того, инфекция в них была непродуктивной, в отличие от инфекции бокаловидных и реснитчатых клеток эпителия.
Дальнейший анализ эпителиальных клеток выявил среди них небольшой кластер с чрезвычайно высокой вирусной нагрузкой — более 1000 вирусных РНК на клетку (другие инфицированные клетки в среднем содержали до 10 вирусных РНК). Этот гиперинфицированный кластер составлял всего 4% зараженных клеток, но содержал 67% всех детектируемых РНК вируса. Исследователи предположили роль таких клеток в продукции вирусных частиц. Затем они разделили реснитчатые клетки эпителия на группы в зависимости от состояния. До заражения лишь немногие реснитчатые клетки экспрессировали гены острого ответа на инфекцию, однако на первый день после инокуляции их экспрессия активировалась в значительном (до 50%) числе клеток у участников с устойчивой инфекцией. Такой же эффект наблюдался при транзиторной и абортивной инфекции, однако все перечисленные ниже изменения ученые детектировали только при устойчивой. Так, на третий день появлялись интерферон-активированные реснитчатые клетки, их число достигало максимума на пятый день, после чего экспрессия генов острого ответа прекращалась. В этот же момент появлялись инфицированные и гиперинфицированные реснитчатые клетки. На 10–14 дни уровни интерферон-активированных клеток несколько снижалось, и в клетках вновь начиналась экспрессия генов острого ответа.
Можно ли по профилю экспрессии генов предсказать, какой тип инфекции разовьется у участника? Исследователи попытались сделать это и обнаружили, что у тех добровольцев, у которых вирус не смог вызвать устойчивую инфекцию, была выше экспрессия HLA-DQA2 в иммунных клетках крови и носоглотки. HLA-DQA2 — это слабо охарактеризованный неполиморфный вариант MHC класса II.
Подробное изучение Т-клеточного компартмента позволило авторам работы выявить 54 различных состояния Т-лимфоцитов в крови и носоглотке. Среди них встречались подтипы CD4+, CD8+ и регуляторных Т-клеток, экспрессирующих высокие уровни маркеров активации (CD38, CD28, CD27 и ICOS). При этом экспрессия индуцируемых активацией генов (CD40LG, CD69, LAMP1, TNFRSF9, TNFRSF4, IL2RA и CD274) не повышалась. Авторы отмечают, что сигнатура активации не зависела от клеточного цикла. При этом активированные Т-клетки были специфичны к антигенам SARS-CoV-2.
Наконец, ученые проанализировали, как иммунные реакции на уровне единичных клеток связаны с клиническими проявлениями COVID-19. Они установили, что при устойчивой инфекции самые ранние симптомы появляются в основном на четвертый день после инокуляции, то есть после ряда описанных в работе клеточных и молекулярных реакций. Так, активация генов острого ответа в реснитчатых клеток эпителия, активация MAIT, глобальный интерфероновый сигналинг и истощение провоспалительных моноцитов происходили не позднее, чем на третий день после заражения. Повышение температуры тела достоверно выявлялось только на четвертый день, равно как и симптомы, связанные с верхними дыхательными путями. За этим следовала инфильтрация места инокуляции иммунными клетками (пятый день) и локальная активация интерферонового сигналинга, которая совпадала по времени с трехкратным повышением уровня С-реактивного белка в крови. На седьмой день количество инфицированных клеток достигло максимума; оно снижалось на десятый день, одновременно с этим прошло большинство симптомов.
Проведенная работа подробно описывает динамику клинических проявлений и клеточного иммунного ответа, и ее результаты могут помочь в интерпретации молекулярных изменений при COVID-19, основанной на клинических наблюдениях, и улучшить понимание временных окон для терапии этой инфекции. Авторы предоставляют доступ к полученным ими данным на сайте COVID19CellAtlas.org.
Белок PLSCR1 — важный фактор защиты от коронавирусной инфекции
Источник
Lindeboom, R.G.H., et al. Human SARS-CoV-2 challenge uncovers local and systemic response dynamics. // Nature (2024). DOI: 10.1038/s41586-024-07575-x


 Меню
Меню





 Все темы
Все темы




 0
0