Эффективность противоопухолевых антител повысили, убрав остатки фукозы
В предыдущей работе исследователи из США получили потенциально очень эффективные антитела к Tn (ассоциированному с опухолью углеводородному антигену). Однако присутствие остатков фукозы на N-гликанах антител подавляет антителозависимую клеточно-обусловленную цитотоксичность. В новой работе авторы экспрессировали антитела в клетках, потерявших способность к фукозилированию. Действительно, полученные антитела показали намного большую цитотоксичность на Tn+ клетках in vitro и in vivo.
В большинстве карцином изменяется паттерн гликозилирования, а ассоциированные с опухолью углеводородные антигены (tumor-associated carbohydrate antigens, TACA) — это маркеры прогрессирования опухоли и метастазирования. Наиболее хорошо изучены два TACA — антиген Tn (CD175) и его сиалированный вариант STn (CD175s). Эти антигены часто встречаются в карциномах человека и ассоциированы с плохим прогнозом. Есть свидетельства того, что экспрессия Tn и STn ассоциирована с иммуносупрессией и может способствовать эпителиально-мезенхимальному переходу.
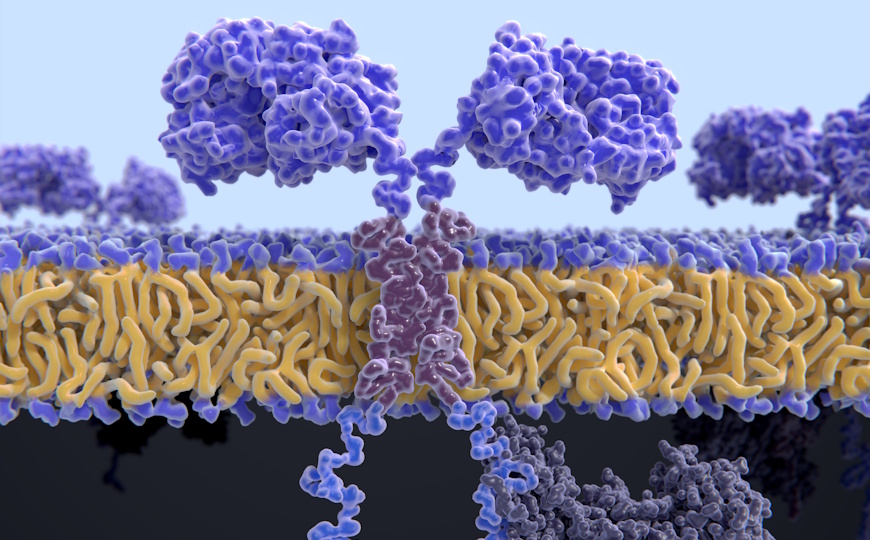
Моноклональные антитела, специфичные к опухоли, достаточно давно используются в терапии рака. У человеческих и мышиных IgG в CH2-домене тяжелой цепи находятся N-гликаны. Они сильно влияют на эффекторную функцию антител. Так, присутствие остатков фукозы на N-гликанах подавляет антителозависимую клеточно-обусловленную цитотоксичность (antibody-dependent cellular cytotoxicity, ADCC). Такое фукозилирование в клетках млекопитающих обусловлено присутствием донора ГДФ-фукозы. Он может вырабатываться de novo, для чего необходимы ферменты ГДФ-манноза 4,6 дегидратаза (GMDS) и синтетаза ГДФ-L-фукозы (FX, TSTA3). Более 90% ГДФ-фукозы вырабатывается de novo. Выработка антител без остатков фукозы производится в клетках с делецией пути фукозилирования (делецией генов fut8, slc35c1, gmds или fx).
Авторы нового исследования ранее уже получили новое рекомбинантное химерное антитело Remab6, которое узнает Tn на различных видах рака, включая опухоли желудочно-кишечного тракта, молочной и поджелудочной желез, мочевого пузыря, простаты и яичников. Однако у этого антитела N-гликаны фукозилированы, так что ADCC-активность подавлена. В новой работе авторы получили антитело в клетках HEK293 с нокаутом FX. Отсутствие эндогенной ГДФ-фукозы приводит к тому, что фукозилирование антител не происходит (Remab6-AF). Активность таких антител изучили in vitro и на мышах.
Клетки с нокаутом гена FX получили из HEK293 с помощью системы CRISPR/Cas9. Авторы таргетировали экзон 4. Анализ гликанов в этих клетках показал отсутствие фукозилирования. Далее в обычных клетках и клетках с нокаутом исследователи экспрессировали рекомбинантный Remab6. В результате получили фукозилированные антитела Remab6 (WT-Remab6) и нефукозилированные Remab6-AF. Уровень фукозилирования оценили с помощью масс-спектрометрии.
Далее исследователи проверили, могут ли клетки с нокаутом FX фукозилировать гликаны в обход de novo синтеза ГДФ-фукозы. Для этого к клеткам добавляли различные концентрации L-фукозы и анализировали уровни фукозилирования на клеточной поверхности методом проточной цитометрии. Действительно, L-фукоза восстанавливала фукозилирование, в том числе на антителах. Эффект зависел от дозы. Таким образом, полученные клетки хорошо подходят для того, чтобы анализировать эффект фукозилирования на терапевтическую эффективность антител.
Цитотоксическую активность антител проверили in vitro. Оказалось, что Remab6-AF имели немного более высокую цитотоксичность, зависящую от системы комплемента (complement-dependent cytotoxicity, CDC). Однако авторы считают, что на это могло повлиять чуть лучшее связывание Remab6-AF с Tn+ клетками.
Далее авторы изучили ADCC в двух разных клеточных линиях. Как и ожидалось, Remab6-AF показали большую цитотоксичность по сравнению с WT-Remab6. Причем Remab6-AF помогают селективно уничтожать только Tn+ клетки в гетерогенной популяции. Также антитела не подавляли рост клеток.
Опыты in vivo провели на мышах с ксенографтами. Одна доза Remab6-AF значительно уменьшала первичную опухоль Авторы заключают, что нефузилированные химерные антитела Remab6-AF — многообещающий терапевтический инструмент для Tn+ карцином человека.
Нормализация архитектуры сосудов опухоли повышает эффективность иммунотерапии
Источник:
Yasuyuki Matsumoto, et al. Targeting Tn-positive tumors with an afucosylated recombinant anti-Tn IgG // Scientific Reports 13, 5027 (2023), published March 28, 2023, DOI: 10.1038/s41598-023-31195-6


 Меню
Меню





 Все темы
Все темы



 0
0