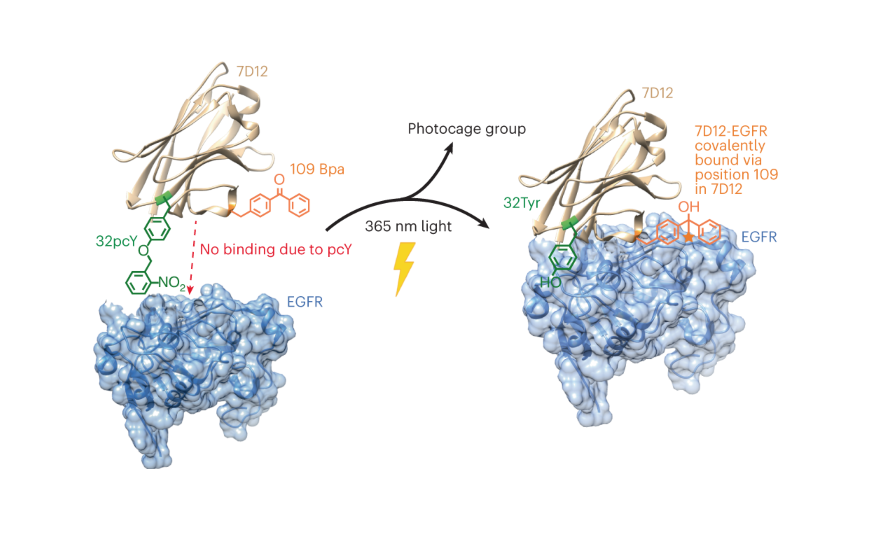
Фрагмент антитела, активируемый светом, ковалентно пришивается к мишени
Полноразмерные терапевтические антитела с трудом проникают в солидные опухоли, а фрагменты антител зачастую недостаточно прочно связываются с мишенью. Британские ученые сконструировали фрагмент антитела с двумя модифицированными аминокислотами, который под воздействием ультрафиолета образует ковалентную связь с рецептором EGFR.
Nat Cheml Biol (2023). DOI: 10.1038/s41589-022-01251-9 | CC BY 4.0
Ученые из Университета Восточной Англии (Норидж, Великобритания) создали биомолекулу для терапии рака — фрагмент антитела, нацеленный на рецептор эпидермального фактора роста (EGFR), который часто гиперэкспрессируется на поверхности опухолей. Фрагмент антитела обладает фотоактивностью и фотореактивностью, иначе говоря, свет вызывает его связывание с рецептором, а затем ковалентное присоединение. Первый эффект обеспечивает включенный в биомолекулу светоактивируемый тирозин (pcY), второй — р-бензоил-β-фенилаланин (Bpa).
Применение антител для таргетной терапии различных заболеваний, в том числе онкологических, — перспективное направление. Но полноразмерные антитела не могут диффундировать в солидные опухоли, а фрагменты антител могут, однако их время пребывания в организме снижено по сравнению с полноразмерными антителами, и зачастую они быстрее диссоциируют от мишени. Одно из решений этой проблемы — замена нековалентного взаимодействия ковалентным с помощью фотокросслинкера. Подобный подход должен также уменьшить побочные эффекты терапии, вызванные связыванием антитела с антигеном на здоровых клетках.
Авторы определили во фрагменте антитела, обозначенном 7D12, позицию для включения Bpa, в которой его влияние на связывание с рецептором будет минимально (в отсутствие подсветки). Под воздействием УФ-излучения с длиной волны 365 нм Bpa-содержащий 7D12 должен был образовать ковалентную связь с EGFR. В свою очередь, pcY присоединялся таким образом, что мешал белку связываться с рецептором, но освещение вызывало отсоединение объемной группы, и присоединение становилось возможным.
Чтобы синтезировать в кишечной палочке белок с двумя нестандартными аминокислотами, исследователи разработали метод сайт-специфического включения pcY и Bpa в 7D12. Они расширили генетический код E.coli — методом направленной эволюции создали специальные тРНК-синтетазы, а также тРНК, одна из которых в процессе трансляции распознавала стоп-кодон UAG в кодирующей последовательности и вызывала включение pcY, а другая распознавала четырехбуквенную последовательность AGUA и включала в белок Bpa.
Авторы убедились, что pcY- и Bpa-содержащий мутант 7D12 без подсветки не связывается с EGFR на поверхности раковых клеток, но облучение светом с длиной волны 365 нм активирует, во-первых, специфическое связывание и во-вторых, образование ковалентной связи с EGFR. Важно, что одна и та же длина волны запускает оба процесса. Взаимодействие является антигенспецифическим, на него не влияет присутствие сыворотки.
Подобная методология может быть применена для создания антител, нацеленных на другие мишени. Фотоактивно-фотореактивные фрагменты антител можно активировать на опухолях вблизи поверхности кожи с помощью носимых УФ-излучающих светодиодов, подобных тем, которые предлагают использовать для лечения дефицита витамина D. УФ-излучение с длиной волны 350 нм проникает на глубину 60 мкм, если кожа не пигментирована; для длины волны 340 нм этот показатель достигает 160 мкм. При большей глубине придется использовать имплантированные светодиоды. Длинноволновый ультрафиолет не так токсичен и опасен для ДНК, как коротковолновый, подчеркивают авторы.
Антитело к (про)рениновому рецептору замедляет рост глиобластомы
Триспецифическое антитело, нацеленное на HER2 и Т-клетки, ингибирует рост опухоли молочной железы
Источник
Bridge, T., et al. Site-specific encoding of photoactivity and photoreactivity into antibody fragments. Nature Chemical Biology (2023). DOI: 10.1038/s41589-022-01251-9


 Меню
Меню





 Все темы
Все темы




 0
0