Генетическая терапия запускает апоптоз врожденного меланоцитарного невуса
Ученые из Великобритании разработали генетическую терапию, которая может облегчить состояние пациентов при редком кожном заболевании — синдроме врожденного меланоцитарного невуса. Авторы использовали малые интерферирующие РНК для ингибирования мутировавшего NRAS в клетках невуса. Эксперименты на культурах клеток и мышиной модели показали, что терапия вызывает апоптоз меланоцитов и улучшает состояние животных.
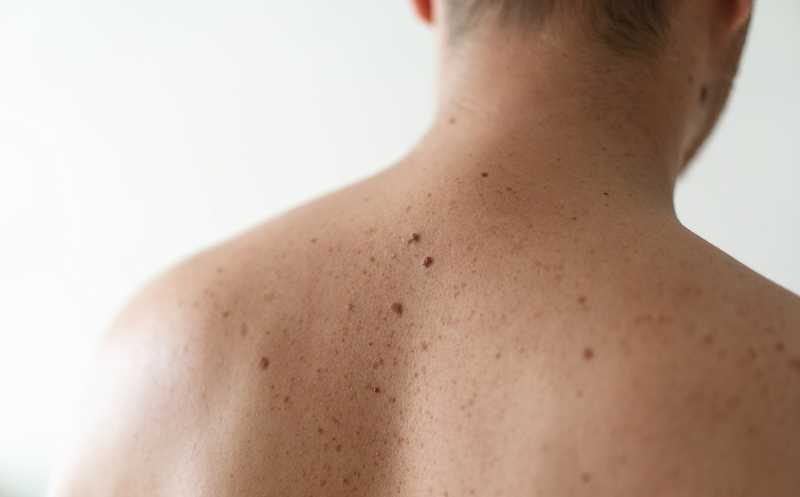
Синдром врожденного меланоцитарного невуса (congenital melanocytic naevus, CMN) — мозаичное нейрокожное заболевание, для которого характерны аберрантная пролиферация меланоцитов и поражения кожи. Причина — в мутациях, которые затрагивают предшественники меланоцитов еще до рождения. Тяжесть проявления CMN сильно варьирует. Тяжелые поражения ассоциированы с повышенной смертностью в детстве. Они вызывают трудно контролируемый зуд, инфекции, повторяющееся развитие узелков, требующих оценки на злокачественность, и трудности с психологической адаптацией у больных и их семей. Если в детстве развивается меланома, часто она приводит к гибели.
В 67% случаев CMN вызывают онкогенные варианты в гене NRAS, чаще всего — вариант NRAS c.181C>A, p.(Q61K). Пероральный ингибитор МЕК траметиниб в некоторой степени облегчал симптомы, однако быстро происходил рецидив, а фенотип в целом не менялся. Необходимо новое эффективное лечение этого заболевания.
Исследователи из Великобритании разработали генетическую терапию, которая может облегчить состояние пациентов с CMN. В ее основе лежат малые интерферирующие РНК (siRNA), нацеленные на мутантный аллель. Оказалось, что подавление NRAS c.181C>A вызвало апоптоз в первичных клетках невуса пациентов in vitro и у трансгенных мышах in vivo.
Авторы провели скрининг различных siRNA на культуре клеток колоректального рака HCT116. Они отметили siRNA8, которая подавляла сигнальный путь МАРК в клетках и была наиболее специфичной. Дальнейшие эксперименты подтвердили, что siRNA8, далее обозначаемая как siNRASQ61K, подавляла активацию сигнального пути МАРК и пролиферацию первичных клеток невуса пациентов.
РНК-секвенирование, проведенное в первичных клетках невуса до и после лечения, показало, что экспрессия мутантного NRAS была значительно подавлена после добавления siNRASQ61K, тогда как экспрессия KRAS и HRAS оставалась неизменной. Ученые также выявили значительное ингибирование экспрессии ARL6IP1 (ARMER). Он защищает клетки от апоптоза, соответственно, его подавление свидетельствует об активации клеточной гибели. Экспрессия других белков, защищающих клетки от апоптоза, была также подавлена при ингибировании NRAS, тогда как уровни каспаз были повышены. В совокупности эти результаты говорят об активации апоптоза в клетках невуса под действием siNRASQ61K. Сравнение с траметинибом показало большую эффективность siRNA.
Затем авторы разработали способ доставки siNRASQ61K к клеткам невуса in vivo. Они использовали самосборные наночастицы, нацеленные на рецептор KIT на поверхности меланоцитов клеток (receptor-targeted nanoparticles, RTNP). Наночастицы успешно достигали дермы экспланта кожи пациента и мышиной модели CMN. Было показано, что siNRASQ61K-RTNP снижали экспрессию мутантного аллеля NRAS. На этом этапе не наблюдалось никаких побочных эффектов в месте инъекции, терапия также не влияла на поведение мышей или на их состояние здоровья в целом.
Полученные данные показывают, что защита от апоптоза играет критически важную роль в сохранении меланоцитарных невусов, вызванных мутациями в NRAS, а терапия аллель-специфической siRNA устраняет эту защиту. Данное исследование открывает новые пути для лечения CMN и других ассоциированных с RAS заболеваний.
Источник:
Bryant D., et al., RNA therapy for oncogenic NRAS-driven naevi induces apoptosis. // The Journal of Investigative Dermatology (2024), DOI: 10.1016/j.jid.2024.04.031


 Меню
Меню





 Все темы
Все темы




 0
0







