Генетический и эпигенетический ландшафт гепатобластомы
Гепатобластома — одна из самых распространенных опухолей печени у детей. При этом молекулярные механизмы ее возникновения и развития недостаточно изучены. Геномное профилирование 163 образцов детских гепатобластом и гепатоцеллюлярных карцином, проведенное японскими учеными, раскрывает причины клинического и фенотипического разнообразия этих опухолей, а также выявляет потенциальные маркеры для разделения пациентов по группам риска.
Хотя гепатобластома лидирует по частоте среди злокачественных новообразований печени у детей, она относится к редким опухолям. Именно недостаточное число исследованных образцов мешает сформировать четкое представление о молекулярных механизмах канцерогенеза гепатобластомы. Эпидемиологические данные указывают на повышенную частоту развития этой опухоли у детей, родившихся с низкой массой тела. Но такие скудные сведения не удовлетворяют потребностям клиницистов, не позволяют оптимизировать подбор терапии. Анализ геномных и эпигеномных нарушений дает намного более информативен.
Группа под руководством ученых из университета Хиросимы провела масштабное исследование 163 гистологически верифицированных опухолей печени (154 гепатобластом и 9 гепатоцеллюлярных карцином). Были выполнены полногеномное и полноэкзомное секвенирование ДНК, РНК-секвенирование, гибридизация с массивами однонуклеотидных полиморфизмов, анализ метилирования ДНК с помощью чипов Illumina и бисульфитного секвенирования.
Исследователи идентифицировали спектр соматических мутаций, хромосомных перестроек по типу слияния генов, изменения числа копий, а также герминальные мутации 40 генов, «уличенных» в ассоциации с онкозаболеваниями.
Статус «самых часто мутирующих генов при гепатобластоме» получили CTNNB1 (ген белка с двойной функцией, участвующего в регуляции и координации клеточной адгезии и транскрипции) и TERT (ген обратной транскриптазы теломеразы). При этом каждый из них имел свою возрастную нишу. Делеции экзона 3 гена CTNNB1 обнаруживались более чем у 80% пациентов в возрасте до 8 лет, а мутации промотора TERT — у пациентов подросткового возраста. Это позволяет предположить различные пути развития этих злокачественных опухолей.
Анализ аномалий числа копий показал, что большинство исследованных образцов опухоли (71,4%) были хромосомно стабильны.
По данным полногеномного анализа опухолевых клеток гепатобластомы обнаружено, что эта опухоль имеет небольшое количество патогенных нуклеотидных вариантов по сравнению с другими солидными опухолями у детей.
На первый план выходят эпигенетические изменения. Необычным стало обнаружение сверхэкспрессии транскрипционного фактора ASCL 2 в образцах гепатобластомы; ранее аналогичная сперхэкспрессия была отмечена при неоплазиях кишечника. При этом активируется молекулярный сигнальный путь Wnt, чего не наблюдается в гепатоцеллюлярных карциномах. Также были гипометилированы энхансерные участки генома, с которыми связывается ASCL2.
Кроме того, авторы обратили внимание на метилирование промотора гена инсулиноподобного фактора роста 2 (IGF2) — сходные паттерны его метилирования наблюдаются в клетках печени плода. IGF2 стимулирует рост клеток и дифференциацию тканей.
Совокупность «улик» подтверждает, что клеткой, от которой происходят гепатобластомы, является недифференцированный предшественник клеток печени эмбриона — фетальный гепатобласт. Это может быть ASCL2-экспрессирующая клетка, похожая на эпителиальные клетки кишечника, которые, как и опухолевые клетки, активно делятся.
Полученные данные мультиомиксного (геном+эпигеном+транскриптом) профилирования гепатобластомы перспективны как компонент программы стратификации пациентов по группам риска и выбора терапии.
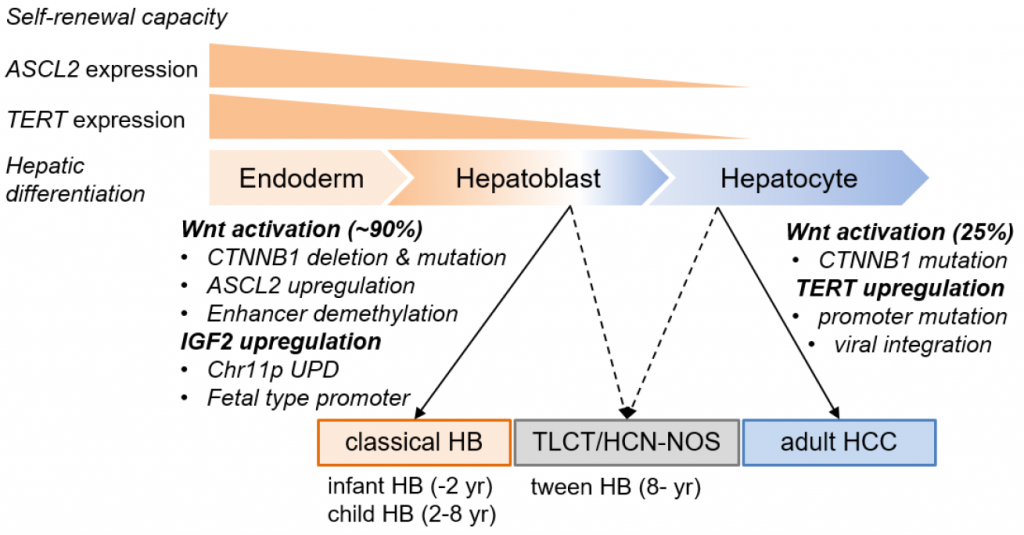 Молекулярные механизмы злокачественных новообразований печени у детей и взрослых. Credit: Eiso Hiyama, Hiroshima University | Пресс-релиз
Молекулярные механизмы злокачественных новообразований печени у детей и взрослых. Credit: Eiso Hiyama, Hiroshima University | Пресс-релиз
Источник
Nagae, G., et al. // Genetic and epigenetic basis of hepatoblastoma diversity. // Nature Communication, 12, 5423 (2021). DOI: 10.1038/s41467-021-25430-9


 Меню
Меню





 Все темы
Все темы




 0
0








