Активация двух генов заставила стволовые клетки собраться в эмбриоид
Авторы статьи в Cell Stem Cell предложили создавать модельные эмбрионы из эмбриональных стволовых клеток (ЭСК), не обрабатывая их морфогенами и факторами роста. Вместо этого они воспользовались эпигенетическим перепрограммированием с помощью CRISPR-активации. С ее помощью в ЭСК мыши индуцировали экспрессию генов Cdx2 или Gata6, участвующих в формировании ранних эмбриональных структур. Совместная культивация обоих модифицированных вариантов с ЭСК дикого типа приводила к тому, что в культуре формировались эмбриоиды — трехмерные структуры, близкие по характеристикам к преимплантационному эмбриону мыши.
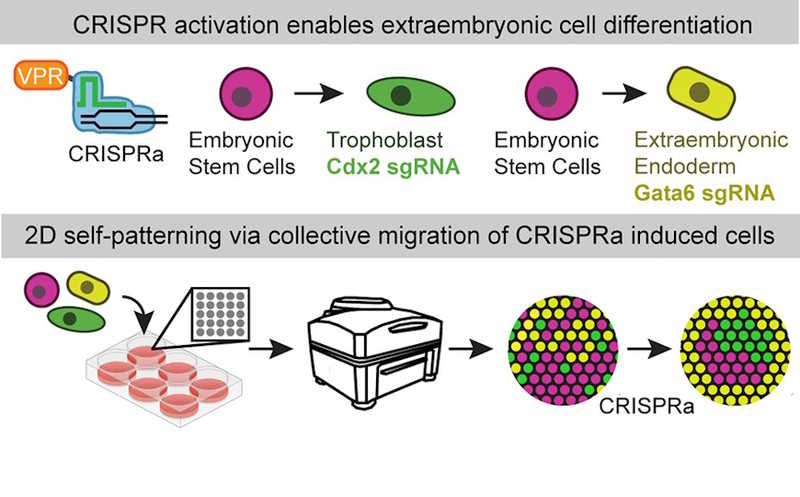
Исследования эмбрионального развития человека и других млекопитающих сопряжено как с техническими трудностями, так и с этическими ограничениями. Одно из возможных решений — создание моделей эмбрионов на основе стволовых клеток (SEM). В ходе эмбриогенеза происходит дифференцировка специализированных типов клеток, которые совместно развиваются в эмбрион. Однако вмешательство в работу регуляторных элементов, управляющих самоорганизацией эмбриональных стволовых клеток (ЭСК), требует дальнейшего освоения. Ученые из США показали, что получить модели эмбрионов из ЭСК можно при помощи CRISPR-активации (CRISPRa) двух генов.
Основные типы клеток, составляющие периимплантационный эмбрион мыши, исследователи получили с помощью доксициклин-индуцируемой системы CRISPRa. Таким способом они дифференцировали из ЭСК стволовые клетки эпибласта (Epi), стволовые клетки трофобласта (TSC) и внезародышевые эндодермоподобные клетки (XEN). Для этого в ЭСК активировали два транскрипционных фактора — Cdx2 и Gata6, которые экспрессируются в TSC и XEN-клетках, соответственно. Гидовые РНК нацелили на регуляторные элементы этих генов, руководствуясь повышенной доступностью хроматина в этих участков при естественной дифференцировке TSC и XEN. Через 24 часа после индукции экспрессия Gata6 наблюдалась в 90% клеток, причем она сопровождалась экспрессией Foxa1/2 и Sox17 — маркеров XEN, — а также снижением уровня Pou5f1(Oct4), маркера плюрипотентности. Аналогичным образом подтвердилась экспрессия Cdx2 после индукции CRISPRa.
Ученые предположили, что активация ключевых регуляторных элементов, связанных с эмбриогенезом, может способствовать пространственной самоорганизации клеток. Чтобы проверить это, они совместно культивировали три варианта ЭСК — дикого типа и с индуцибельным Gata6 и Cdx2. Клетки высаживали так, чтобы они сформировали округлые колонии, и проводили индукцию CRISPRa проводили в течение 72 часов. Затем авторы окрашивали колонии на Foxa1/2, Cdx2 и Pou5f1(Oct4). Оказалось, что клетки образовывали упорядоченные паттерны: Foxa1/2+ формировали кольцеобразную структуру вокруг колонии, внутри которой группировались Cdx2+ и плюрипотерные Pou5f1+. Такая организация напоминает естественные эмбрионы, в которой клетки XEN окружают эпибласт и экстраэмбриональную эктодерму
Флуоресцентная визуализация отдельных клеток показала, что при активации Gata6 и Cdx2 они начинают мигрировать, причем Cdx2+-клетки собирались вместе, а Gata6+ смещались на периферию колонии. Способность к самоорганизации подтвердилась и в трехмерной модели — клетки формировали упорядоченные структуры, которые авторы обозначили как эмбриоиды.
Пространственная транскриптомика эмбриоидов выявила шесть кластеров клеток. Два из них экспрессировали Nanog и в целом были транскрипционно схожи с клетками эпибласта. Их обозначили как Epi1 и Epi2. Два других кластера — XEN1 и XEN2 — экспрессировали Gata6, первый из них был обогащен обогащен маркерами эмбриональной висцеральной эндодермы (Otx2, Cer1 и Lhx1), второй — маркерами экстраэмбриональной висцеральной эндодермы (Pdgfra и Sox17). Аналогичным образом, наблюдались две различные популяции клеток, экспрессирующих Cdx2, аннотированные как TS1 и TS2
Исследователи выдвинули гипотезу, что совместная дифференцировка клеток с индуцированными Cdx2 и Gata6 может способствовать обмену сигналами. Они проанализировали сигнальные взаимодействия между клетками с помощью CellChat и обнаружили как хорошо известные регуляторы раннего эмбриогенеза, так и менее изученные. К первым относились сигнальные пути фактора роста фибробластов (Fgf), тромбоцитарного фактора роста (Pdgf) и костного морфогенетического белка (Bmp). Среди прочих выявили путь Hedgehog, неканонический путь Wnt и сигналинг через плексин и семафорин.
Дальнейший детальный анализ показал, что полученные эмбриоиды схожи с моделями трех-четырехдневных эмбрионов мыши, выращенных более традиционным методом. Сходство наблюдалось как на молекулярном уровне, так и по количеству клеток того или иного типа. Основное отличие состояло в том, что трофобластоподобные клетки, которые формировались в данных экспериментах, были незрелыми.
Исследователи заключают: эмбриональные стволовые клетки способны координировать движение и рост даже без добавления морфогенов. Активация всего двух генов с помощью CRISPR заставила клетки самоорганизоваться в эмбрионоподобные структуры, которые могут послужить моделью для изучения эмбриогенеза.
Мобильные элементы LINE1 не дают эмбриональным стволовым клеткам дедифференцироваться
Источник
Gerrald A. Lodewijk, et al. Self-organization of mouse embryonic stem cells into reproducible pre-gastrulation embryo models via CRISPRa programming. // Cell Stem Cell, 2025.DOI: 10.1016/j.stem.2025.02.015


 Меню
Меню





 Все темы
Все темы



 0
0