Судьбу некоторых клеток формирующегося эмбриона определяет фактор роста фибробластов
Исследователи из Великобритании и Канады выяснили, как плюрипотентные клетки в эмбрионе человека «решают», в какую линию им дифференцироваться. Они показали, что ключевую роль в формировании гипобласта — клеток, из которых впоследствии формируется желточный мешок, — играет сигнальный путь факторов роста фибробластов (FGF).
Credit:
Cell Stem Cell, 2024. DOI: 10.1016/j.stem.2024.05.003 | CC BY
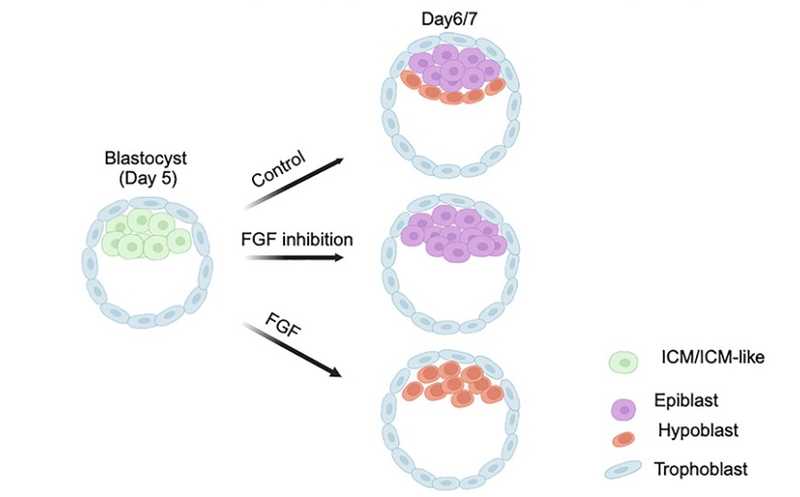
Бластоциста состоит из трех первичных линий: эпибласта, трофобласта и гипобласта — из них развиваются эмбрион, плацента и желточный мешок, соответственно. В ходе формирования бластоцисты происходит две сегрегации линий — сначала трофобласт отделяется от внутренней клеточной массы, а затем последняя разделяется на эпибласт и гипобласт. Производные гипобласта крайне важны для поддержания нормального развития эмбриона, однако из-за ограниченного доступа к эмбрионам человека и этических причин знания о регуляторных механизмах, контролирующих развитие гипобласта и его производных, остаются фрагментарными. Авторы статьи в Cell Stem Cell предложили моделировать эти процессы на стволовых клетках и выяснили, что важную роль в дифференцировке гипобласта играет сигнальный путь FGF — раньше его не считали настолько значимым в этом процессе у человека.
Трофобласт у человека начинает формироваться примерно на четвертый день после оплодотворения, а на шестой-седьмой выделяется линия клеток гипобласта. Ранее авторы работы показали, что наивные плюрипотентные стволовые клетки (НПСК) человека дифференцируются преимущественно в трофобласт, если культивировать их в присутствии ингибиторов MEK/ERK и Activin/Nodal. Если же клетки обрабатывать ингибиторами только первые сутки культивации, то формируется смешанная культура, содержащая также клетки гипобласта.
Ученые создали клеточную линию НПСК, несущую два репортера — OCT4-EmGFP и SOX17-tdTomato — для отслеживания экспрессии OCT4 (маркер плюрипотентости) и SOX17 (маркер гипобластов). В постоянном присутствии ингибиторов клетки переставали экспрессировать оба маркера, однако экспрессировали маркер трофобласта GATA3. При суточной обработке ингибиторами в популяции появлялись SOX17-tdTomato-положительные клетки. В целом через три дня культивации в таких условиях формировалась смешанная культура, содержащая около 20% SOX17-tdTomato-положительных и около 60% OCT4-EmGFP-положительных клеток, а еще 20% не экспрессировали ни один из маркеров. В отсутствие ингибитора клетки оставались в плюрипотентном состоянии.
С помощью транскриптомного анализа исследователи показали, что дифференцировка клеток гипобласта in vitro схожа с формированием гипобласта в ходе эмбриогенеза. Для этого они сравнили два набора данных транскриптомики единичных клеток — полученных на человеческих эмбрионах и в ходе данной работы. Данные по эмбриональному развитию охватывают доимплатнационный период (3–7 дней после оплодотворения) и культивируемые in vitro постимплантационные эмбрионы (8–14 дней). Результаты UMAP демонстрируют непрерывную траекторию формирования гипобласта. Кроме того, авторы определили по данным РНК-секвенирования гены, характерные для гипобласта, но не дефинитивной эндодермы, такие как PDGFRA, RSPO3, HNF4A и LGALS2. Все эти гены активно экспрессировались в гипобласте, полученном из НПСК.
Авторы исследования заключили, что ингибирование MEK/ERK обеспечивает потенциал для дифференцировки НПСК в клетки гипобласта, но для дальнейшей специализации клеток это ингибирование должно быть снято. Важную роль в определении судьбы мышиных гипобластов играет сигнальная ось FGF/ERK/GATA6, и исследователи решили подробнее изучить функцию FGF-сигналинга при дифференцировке гипобласта. Они использовали ингибитор рецептора FGF, добавляя его либо сразу после окончания действия других ингибиторов, либо через сутки после этого. Оказалось, что в первом случае SOX17-tdTomato-положительных клеток становилось намного меньше, чем в контроле. А вот отсроченное ингибирование почти не оказывало такого воздействия. Таким образом, большинство клеток уже начали дифференцироваться в гипобласты через 24 часа после суточного ингибирования MEK/ERK и Activin/Nodal.
Полученные результаты авторы подтвердили на бластоиде — трехмерной клеточной модели бластоцисты. Кроме того, они проверили их и на формирующихся эмбрионах. Для этого ученые взяли пятидневные бластоцисты и обработали их ингибитором рецептора FGF. Спустя 24–40 ч эмбрионы окрашивали на NANOG (маркер эпибласта), SOX17 или FOXA2 (маркеры гипобласта) и GATA3 (маркер трофобласта). Во всех контрольных эмбрионах внутренняя клеточная масса содержала SOX17+ или FOXA2+ клетки гипобласта. Среди эмбрионов, обработанных ингибитором FGF-сигналинга, два не содержали внутренней клеточной массы вовсе, еще семь были лишены гипобластов. В среднем эмбрионы в опытной группе содержали большее количество клеток эпибласта, чем контрольные.
Наконец, чтобы выяснить, может ли FGF способствовать формированию гипобластов, ученые культивировали пятидневные бластоцисты в среде, содержащей FGF2. Когда в полученных поздних бластоцистах оценили количество FOXA2+ и NANOG+ клеток, оказалось, что дифференцировка сместилась в направлении гипобласта — его клеток в бластоцистах было больше, а клеток эпибласта меньше.
Полученные результаты свидетельствуют о ключевой роли FGF в дифференцировке линии гипобласта в ранних бластоцистах человека и согласуются с результатами, полученными на эмбрионе мыши.
Модель человеческого эмбриона возрастом две недели получена из стволовых клеток
Источник
Anish Dattani, et al. Naive pluripotent stem cell-based models capture FGF-dependent human hypoblast lineage specification. // Cell Stem Cell, 2024. DOI: 10.1016/j.stem.2024.05.003


 Меню
Меню





 Все темы
Все темы



 0
0