Из гамет двух самцов вырастили мышей, отредактировав в них локусы импринтинга
Применение эмбриональных стволовых клеток (ЭСК) для клонирования и регенеративной медицины осложняется аномалиями импринтинга. Китайские исследователи задались вопросом: только ли импринтинг мешает искусственно вырастить потомство из клеток двух млекопитающих одного пола? Чтобы это проверить, они получили мышат от двух самцов. С помощью CRISPR-Cas ученые отредактировали в генетическом материале сперматозоидов локусы импринтинга. Из таких модифицированных клеток, лишенных ядра ооцитов и неотредактированных сперматозоидов мыши исследователи «собрали» ЭСК, которые имплантировали самкам для вынашивания. В общей сложности потребовалось отредактировать 20 локусов, и такое редактирование обеспечило формирование нормальной плаценты и полноценное развитие эмбрионов, из которых удалось вырастить взрослых мышей.
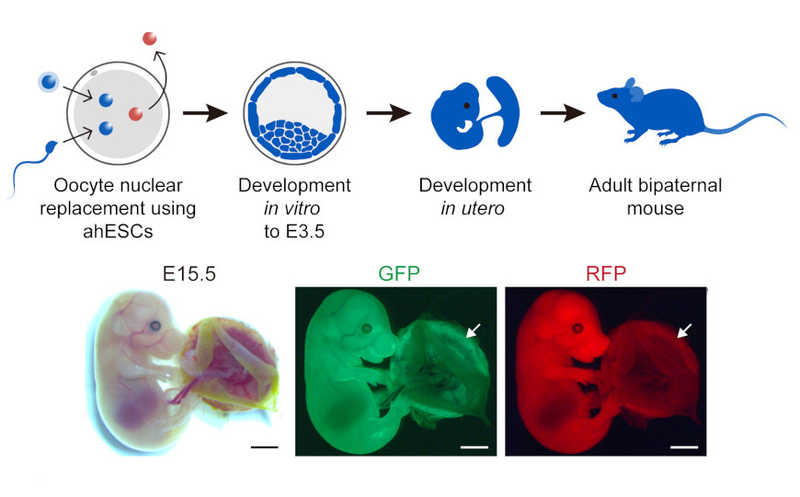
Для получения эмбриона из гамет двух отцов в ооцит, лишенный ядра, вводили неотредактированный сперматозоид, меченный RFP, и гаплоидную клетку, полученную нокаутом 20 локусов импринтинга и меченную GFP. Экспрессия обоих флуоресцентных белков равномерно наблюдалась по всему телу эмбриона на 15-й день развития.
Credit:
Cell Stem Cell, 2025. DOI:
10.1016/j.stem.2025.01.005 |
CC BY
Аномалии импринтинга серьезно затрудняют применение эмбриональных стволовых клеток (ЭСК), индуцированных плюрипотентных стволовых клеток (иПСК) и клонирование животных. При этом универсального метода их исправления пока не существует. Без генетического вмешательства искусственно созданные эмбрионы млекопитающих, полученные из клеток двух матерей или отцов, оказываются нежизнеспособны — авторы статьи в Cell Stem Cell предполагают, что их развитию препятствуют аномалии импринтинга. Разработка подхода для «починки» таких аномалий позволила бы усовершенствовать выращивание эмбрионов из стволовых клеток и стимулировать развитие регенеративной медицины.
Японские ученые уже сообщали о выращивании яйцеклетки из эмбриональных стволовых клеток (ЭСК) самца мыши. В итоге они сумели получить из таких яйцеклеток живых мышат, однако для этого им потребовалась выращивать ЭСК в эмбрионах мышей, а затем скрещивать полученных химерных животных — их потомство и было потомством самца-«донора» ЭСК. Однако вырастить жизнеспособные эмбрионы из сперматозоидов и яйцеклеток, полученных in vitro из клеток одного самца, этим исследователям не удалось — и они тоже связывают этот неуспех с импринтингом.
Коллектив биологов из Китая также занимается решением этой задачи. Ранее ученые опубликовали исследование, в котором модифицировали все семь областей импринтинга, ассоциированные с летальностью при получении эмбриона из клеток двух отцов. Однако и в этом случае эмбрионы оказались нежизнеспособны. Исследователи задались вопросом: являются ли здесь гены импринтинга единственным препятствием?
Авторы ввели сперматозоид мыши в ооцит, из которого удалили ядро, — тем самым они получили гаплоидные ЭСК. После делеции семи локусов импринтинга с помощью CRISPR-Cas9 в ядро такой клетки вводили вместе с другим сперматозоидом в еще один ооцит, также подвергнутый энуклеации. Полученные «двухотцовские» ЭСК использовали для выращивания эмбрионов. Семи генетических модификаций оказалось недостаточно — мышата были нежизнеспособны, у них отмечался избыточный вес, отеки, пупочная грыжа, увеличение внутренних органов и другие аномалии развития, например, они были неспособны нормально дышать и сосать. Такие патологии подтверждают теорию конфликта импринтинга, согласно которой отцовские гены способствуют росту, а материнские — ограничивают его. Для решения этой проблемы авторы внесли дополнительные изменения в локусы, связанные с избыточным ростом (в сумме получилось 18 модификаций).
ЭСК с 18-ю исправлениями приживались лучше — полностью развились 13,0% ± 8,7% подсаженных эмбрионов дпо сравнению с 5,3% ± 1,7% без модификаций. Отеков и пупочных грыж у мышат уже не наблюдалось, и они нормально дышали с момента рождения, однако все еще испытывали трудности с питанием и не могли сосать молоко. Посмотреть, как кормят такого нокаутного мышока, можно по ссылке.
Исследователи обратили внимание, что у полученных от двух отцов мышей аномально экспрессировался локус Blcap-Nnat, для которого также характерен консервативный импринтинг. У людей патологии NNAT связаны с краниофациальными дисморфиями. Тогда авторы провели девятнадцатый нокаут — он восстановил нормальную экспрессию Nnat и Blcap, а также исправил дефект питания и преждевременное открытие век. Мыши нормально развивались до взрослого возраста даже без искусственного вскармливания (общая выживаемость составила 36,7%).
Однако на этом отклонения развития не закончились — 19KO-мыши все еще росли быстрее, чем полученные естественным путем, у них был уменьшен размер гиппокампа, а уровень тревожности был ниже нормы (в поведенческом тесте открытого поля они не боялись выходить в центр, как мыши дикого типа). Кроме того, их развитие требовало отдельной подсадки в бластоцисту, поскольку без этого дополнительного этапа — при прямом переносе эмбрионов, полученных из гаплоидных 19КО-ЭСК и сперматозоидов, — плацента не могла сформироваться нормально и такие эмбрионы погибали. Авторы выявили еще один ключевой участок генома, в котором требовалось исправить импринтинг. Им оказался локус Sfmbt2, кодирующий 72 малых интерферирующих РНК — они также подвергались импринтингу и оверэкспрессировались в 19КО-эмбрионах. Делеция этого участка обеспечила нормальное формирование плаценты и полноценное развитие эмбрионов мышей.
Мыши с 20-ю нокаутами, полученные от двух отцов, демонстрировали нормальную стабильную экспрессию не подвергающихся импринтингу генов в различных органах и тканях. Авторы работы проанализировали механизмы, благодаря которым множественный нокаут импринтируемых участков позволил получить потомство из клеток двух самцов. С помощью Hi-C, ATAC-seq и омиксного анализа они охарактеризовали сеть регуляторных взаимодействий. В частности, Peg13 — один из ключевых генов, которые потребовалось отредактировать для получения нормального потомства, — отвечал за репрессию транскрипции некоторых других регуляторных генов в мозге мышей. Делеция его промотора воспроизводила экспрессию, которая должна наблюдаться при неодинаковом импринтинге, то есть при получении потомтством как отцовского, так и материнского генетического материала. Однако исследователи подчеркивают, что обнаруженный механизм требует более детального экспериментального подтверждения.
Авторы работы подчеркивают, что их подход не полагается на эпигенетическое перепрограммирование, необходимое для природной дифференцировки гамет — вместо него они модифицировали импринтинг напрямую. Стратегия позволяет обойти строгие требования к поддержанию плюрипотентности клеток, что расширяет ее применимость (в том числе, по словам исследователей, для межвидового применения). Также работа подчеркивает значимость неканонических механизмов импринтинга в развитии млекопитающих.
Полученные данные доказывают, что основным препятствием для однополого размножения млекопитающих служат аномалии импринтинга, однако практическое применение разработанного подхода куда шире: с его помощью можно оптимизировать выращивание ЭСК и клонирование, а также расширить потенциал персонализированной регенеративной медицины.
Источник
Zhu-kin Li et al. Adult bi-paternal offspring generated through direct modification of imprinted genes in mammals. // Cell Stem Cell, Published online January 28, 2025. DOI: 10.1016/j.stem.2025.01.005


 Меню
Меню





 Все темы
Все темы




 0
0








