Как вырастить яйцеклетку из хвоста самца
Японские ученые, недавно сообщившие о развитии яйцеклеток из соматических клеток самцов мыши, опубликовали статью об этой работе в Nature. Они не только получили здоровых мышат из этих яйцеклеток, оплодотворенных сперматозоидами самца дикого типа, но и добились рождения мышат — потомков одного самца. Правда, для этого пришлось создать химерных мышей.
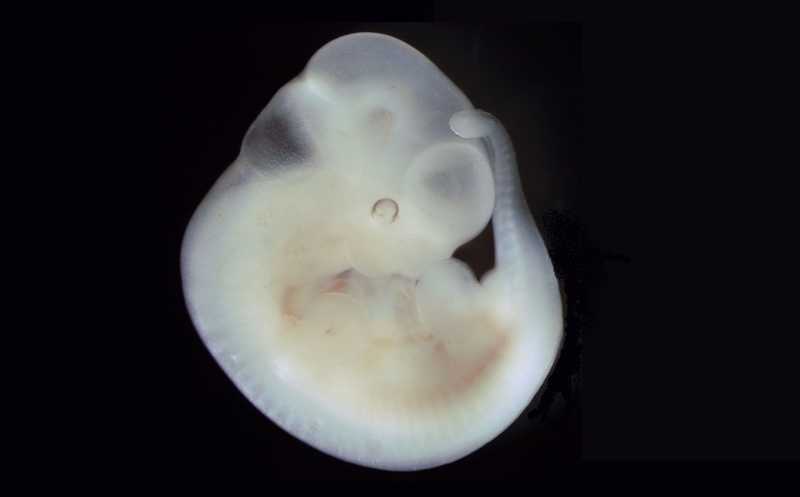
Выращивание плюрипотентных стволовых клеток in vitro может привести к таким аномалиям, как анеуплоидия — изменение числа хромосом. Это проблема на пути к их терапевтическому применению. Но японские ученые сумели использовать анеуплоидию, возникающую при культивировании, чтобы превратить эмбриональные стволовые клетки, а затем и индуцированные плюрипотентные стволовые клетки самца мыши в яйцеклетку, и в итоге получили из таких яйцеклеток живых мышат.
В 2020 году группа Кацухико Хаяси, который сейчас работает в Университете Осаки, описала транскрипционные факторы, необходимые для превращения плюрипотентных клеток в ооцитоподобные клетки in vitro. В 2021 году та же группа воссоздала соматическую среду, в которой ооциты прошли все необходимые стадии развития. Из индуцированных плюрипотентных стволовых клеток (иПСК) мышей ученые получили клетки, подобные соматическим клеткам ткани яичника, и выращивали их вместе с первичными зародышевыми клетками, также полученными из иПСК. Образовывались фолликулы, в них первичные зародышевые клетки вступали в мейоз и развивались в жизнеспособные ооциты, из которых авторам удалось получить мышат. В новой работе они сделали следующий шаг: получили яйцеклетки из клеток самца.
На начальном этапе авторы использовали первичные зародышевые клетки — предшественники сперматозоидов или ооцитов в эмбрионе. Они мигрируют в гонады, и начальные этапы созревания определяются их соматическим окружением. Однако на более поздние стадии созревания влияет хромосомный статус. Первичные зародышевые клетки с кариотипом XX не могут дифференцироваться в сперматогонии. XY-клетки, как убедились авторы работы, могут проходить начальные стадии дифференцировки в ооциты in vitro, в подходящем окружении, но из-за неправильного спаривания половых хромосом при мейозе и ингибирующего действия генов Y-хромосомы оогенез нарушался на поздних стадиях.
Авторы пришли к выводу, что для получения ооцитов необходимо удалить Y-хромосому и (или) дублировать Х-хромосому. Они выращивали в культуре эмбриональные стволовые клетки (ЭСК) самца мыши, и после восьми пассажей около 6% субклонов потеряли св ою Y-хромосому, что подтвердили с помощью ПЦР. Затем надо было удвоить Х-хромосому. Клетки, с которыми работали ученые, имели ген красного флуоресцентного белка DsRedв своих Х-хромосомах, что позволяло отличать кариотип ХО от ХХ (в эмбриональных стволовых клеток обе Х-хромосомы транскрипционно активны, выключение одной из них происходит позже). Флуоресцентно-активная сортировка и флуоресцентная гибридизация in situ обнаружили клетки с двумя Х-хромосомами. Чтобы повысить их выход, авторы использовали реверсин, ингибитор контрольной точки сборки веретена, который способствует неправильному расхождению хромосом, а значит, увеличивает вероятность появления ХХ-клеток.
Затем авторы получили из ЭСК с кариотипом ХХ первичные зародышевые клетки, используя свой протокол с фолликулярными клетками. Заключительным этапом было оплодотворение in vitro спермой дикого типа, в результате были получены эмбрионы, которые можно было перенести в матку мыши.
Аналогичную процедуру исследователи провели с иПСК, которые получили из фибробластов из кончиков хвостов восьминедельных самцов мыши. Ооциты успешно развились, их оплодотворили сперматозоидами мышей дикого типа; двухклеточные эмбрионы перенесли суррогатным матерям и получили потомство. Правда, с низким выходом: 7 на 630 трансплантаций.
Этих детенышей отличал темный цвет глаз из-за экспрессии DsRed и маркеров плюрипотентных стволовых клеток (Sox2 и Pou5f1), отмечают авторы. Все мышата благополучно выросли, на фертильность проверили одного самца и одну самку, и оба оказались плодовитыми.
Авторы попытались получить потомство от одной линии мужских иПСК (ранее это удавалось для кариотипов ХО и XY; такие технологии позволяют выводить «чистые линии» экспериментальных животных с мутациями в обеих аллелях). Для этого они создали химерных мышей: внедрили полученные от одного и того же самца иПСК с женским или мужским кариотипом в эмбрионы мышей линии BALB/c на стадии бластоцисты. Химерных самок и самцов скрестили и получили мышат, которые были потомками единственного родителя. Однако авторы не смогли вырастить жизнеспособные эмбрионы из сперматозоидов и яйцеклеток, полученных in vitro из клеток одного самца; возможно, из-за специфических для пола импринтинговых меток в ДНК, которые «переписались» в химерных животных.
И еще один интересный результат: зрелые ооциты не получались из клеток с тремя хромосомами 16, но когда «лишняя» хромосома была потеряна при культивировании с реверсином, созревание в яйцеклетку стало возможным. Это говорит о возможности лечения бесплодия при хромосомных аномалиях.
Теоретически эта технология может позволить иметь биологических детей однополым парам (о чем уже написали многие комментаторы), но более реалистичными выглядят другие применения. Предложенная авторами стратегия скрининга клеток, потерявших хромосому, может быть использована для поисков ответа на вопрос, почему у разных хромосом различная вероятность неправильной сегрегации. Технология также делает возможным спасение исчезающих видов животных, даже если остался один самец (при условии, что есть самка близкородственного вида, которая выносит эмбрион). Но все потенциальные применения, связанные с репродукцией, пока ограничивает низкая эффективность. Кроме того, еще неизвестно, будет ли протокол работать с клетками человека.
Источник
Murakami, K., et al. Generation of functional oocytes from male mice in vitro. Nature (2023). DOI: 10.1038/s41586-023-05834-x


 Меню
Меню





 Все темы
Все темы




 0
0








