Генная коррекция серповидноклеточной анемии
С помощью CRISPR-Cas9 можно эффективно лечить серповидноклеточную анемию, редактируя участок, несущий мутацию, или повреждая мутантный ген. Во втором случае активируется и компенсирует симптомы заболевания другой ген — ген фетального гемоглобина.
Серповидноклеточная анемия, от которой страдает около миллиона людей по всей планете, — наследственное заболевание, вызывающее сильные боли, повреждения органов и раннюю смерть. Из-за единичной мутация в бета-субъединице гемоглобина (бета-глобине) нормальные эритроциты принимают характерную форму серпа. Такие клетки повреждают стенки сосудов и забивают мелкие кровеносные сосуды, препятствуя поступлению крови к тканям.
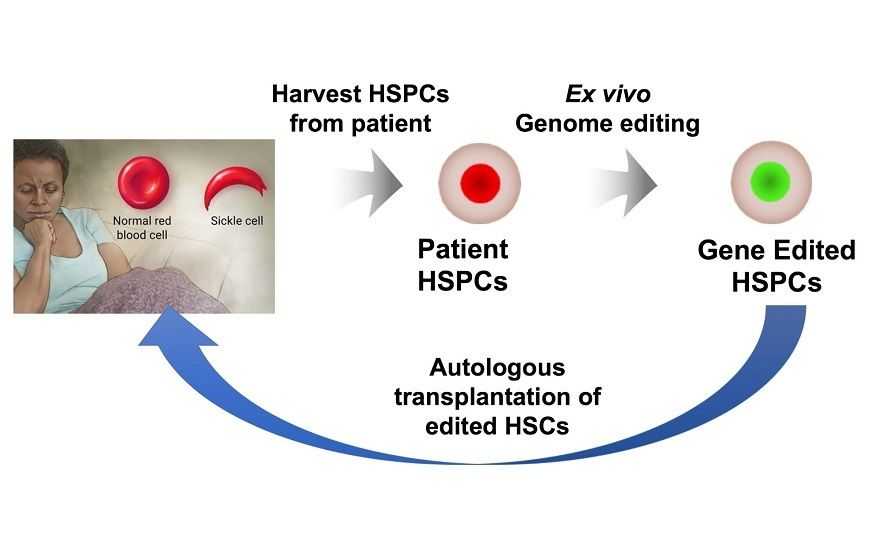
Сейчас пациентов с этим заболеванием лечат стволовыми клетками от подходящих доноров, обычно родственников, но их удается найти менее чем для 15% больных. Однако если бы можно было модифицировать собственные стволовые клетки крови (СКК) пациента, которые дают начало всем клеткам крови, лечение стало бы доступно и другим больным.
Предполагается, что клетки будут брать из костного мозга пациента, редактировать геном, тестировать на предмет точности редактирования, а затем трансплантировать обратно. Перед этим пациенту назначат химиотерапию, чтобы снизить количество его собственных СКК и освободить место для новых, отредактированных, которые будут впоследствии производить здоровые клетки крови.
В новом исследовании Ган Бао и его команда из университета Райса в сотрудничестве с группами из Стэнфордского университета, Бэйлорского медицинского колледжа и Техасской детской больницы впервые тестировали эту процедуру на животных. СКК, полученные в лаборатории Вивьен Шиан (Бэйлорский колледж) из периферической крови или костного мозга пациентов с серповидноклеточной анемией, редактировали и пересаживали мышам с врожденно подавленной продукцией клеток иммунной системы. Оказалось, что отредактированные клетки способны жить и функционировать в организме животного не менее 4 месяцев.
Шиан и ее сотрудники изучили гемоглобин, который производили отредактированные клетки. Выяснилось, что они могут производить гемоглобин в достаточном количестве, чтобы предотвратить образование серповидных клеток, даже в условиях суровой гипоксии, которая этому способствует.
Ранние тесты с использованием Cas9-белка дикого типа, полученного от Streptococcus pyogenes, приводили к образованию стволовых клеток с большим количеством нецелевых изменений ДНК, включая крупные делеции хромосом и инверсии, которые также могут стать причиной серьезных заболеваний. Использование более точной версии Cas9, разработанной Integrated DNA Technologies, значительно уменьшило число незапланированных изменений.
Удалось исправить не все стволовые клетки, взятые у пациента с мутацией серповидноклеточной анемии, — в лучшем случае не более 40%. (Хотя и это достаточно неплохой результат.) Еще в 50% клеток, в которых ДНК, разрезанная Cas9, была восстановлена не по механизму гомологичной репарации (HDR), а по механизму негомологичного воссоединения концов (NHEJ) — то есть мутантный аллель повреждался — существенно увеличился синтез фетального гемоглобина, который кодируется другим геном, не имеющим мутации. Ген фетального гемоглобина экспрессируется только у плода и, как правило, выключается через несколько месяцев после рождения. Этот белок, как и обычный гемоглобин, подавляет эффекты серповидноклеточной анемии. Бао полагает, что если в отредактированных клетках сохранится экспрессия фетального гемоглобина, в 90% стволовых клеток пациента мутантный гемоглобин будет или починен, или заменен фетальным. «Мы надеемся, что этого будет достаточно, чтобы вылечить заболевание», — сказал Бао.
По его словам, те 10%, что продолжат производить серповидные клетки, не представляют опасности. Нормальные эритроциты живут примерно в девять раз дольше, чем серповидные, поэтому со временем большинство эритроцитов станут нормальными. В целом метод представляется более безопасным по сравнению с генной терапией на основе лентивирусных векторов, несущих ген бета-глобина дикого типа.
Однако исследователи пока не знают, надолго ли сохранится эффект от повреждения гена бета-глобина, повышающий уровень фетального гемоглобина, и не увеличит ли это риск бета-талассемии (заболевание крови, при котором снижается продукция гемоглобина). Также пока неясно, какой процент СКК надо отредактировать, чтобы эффективно вылечить серповидноклеточную анемию: оценки ученых расходятся от нескольких процентов до 5–10%. Для ответа на этот вопрос понадобятся клинические испытания, но прежде, чем можно будет начать их, необходимо обобщить данные и сделать дополнительные эксперименты, чтобы решить проблемы с безопасностью.
Источники
So Hyun Park, et al. // Highly efficient editing of the β-globin gene in patient-derived hematopoietic stem and progenitor cells to treat sickle cell disease. // Nucleic Acids Research, 2019; DOI: 10.1093/nar/gkz475
Цитаты по пресс-релизу


 Меню
Меню





 Все темы
Все темы




 0
0







