Генная терапия миодистрофии Дюшенна: пока на свиньях
Ученые из Германии продемонстрировали действенный метод терапии одной из самых распространенных генетических болезней — миодистрофии Дюшенна. Эксперименты на свиньях с аналогичной мутацией и человеческих клетках в культуре показали, что функции гена в мышечной ткани восстанавливаются и симптомы заболевания смягчаются.
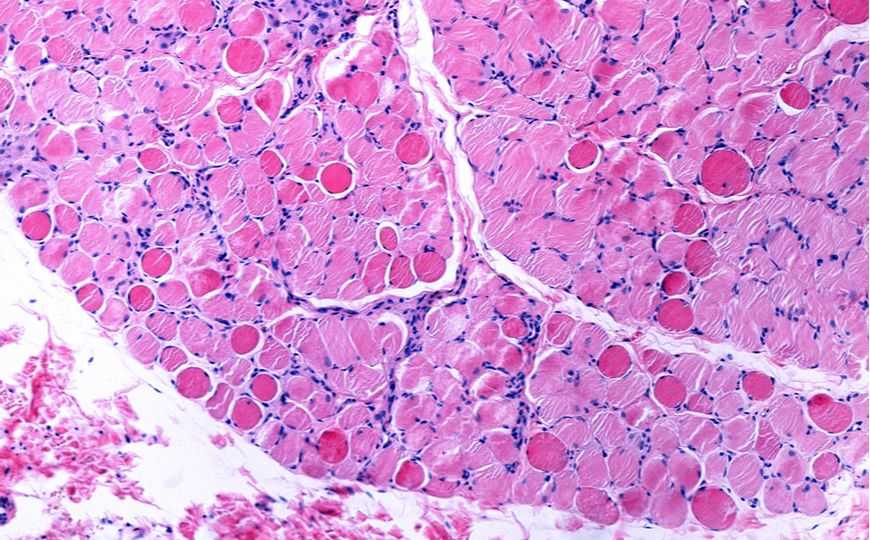
Патологические изменения в мышечной ткани на ранней стадии миодистрофии Дюшенна: отмирающие волокна выглядят гомогенными и ярче окрашены.
Credit: Jose Luis Calvo | Shutterstock.com
Миодистрофия Дюшенна — наиболее частое генетическое заболевание мускулатуры у детей. Это Х-сцепленное заболевание, то есть вызванное мутациями в гене на Х-хромосоме, поэтому в основном им болеют мальчики (один случай на 3 600 новорожденных, тогда как для девочек около 1 на 50 000 000). Причина миодистрофии Дюшенна — имеющиеся в 1 из 5000 Х-хромосом мутации в гене белка дистрофина, (DMD), которые приводят к потере его активности и в итоге к деградации мышечной ткани: дистрофин необходим для ее нормальной регенерации. Болезнь проявляется в возрасте примерно пяти лет и неуклонно прогрессирует: все больше мышечных клеток заменяются жировой или соединительной тканью. К 12 годам большинство больных теряют способность ходить, затем начинаются проблемы с дыханием и сердечной деятельностью. До 40 лет мало кто доживает.
Группа немецких ученых занялась разработкой генной терапии миодистрофии Дюшенна. В качестве модели использовали свиней, у которых из гена DMD удалили 52-й экзон, что привело к полной потере активности дистрофина из-за сдвига рамки считывания. Многие мутации, вызывающие миодистрофию Дюшенна, устроены схожим образом. Модельные животные демонстрировали симптомы миодистрофии, больше 60% поросят-самцов умирало в первую неделю жизни. Для лечения исследователи использовали аденоассоциированный вирусный вектор (AAV9), кодирующий Cas9 и пару РНК-гидов, комплементарных участкам вокруг экзона 51. Гиды были подобраны так, чтобы вырезание экзона 51 привело к восстановлению рамки для последующих экзонов.
Через шесть недель после начала внутримышечного введения компонентов генной терапии ученые обнаружили наличие дистрофина в конечностях больных свиней. Дальнейший анализ показал, что генная модификация достигла цели и ген дистрофина без экзонов 51 и 52 успешно экспрессировался. Несмотря на потерю двух экзонов, укороченный дистрофин оказался функционирующим и состояние мышщ заметно улучшилось: соединительной ткани стало меньше, а сила сокращения выросла. Внутримышечные инъекции не влияли на состояние тканей сердца и диафрагмы. Использовав частицы AAV9, покрытые нетоксичными полиамидоаминовыми наночастицами, исследователи добились экспрессии белка и в этих тканях; состояние кардиомиоцитов улучшилась, уменьшилась сердечная аритмию.
С помощью полногеномного секвенирования ученые удостоверились, что их вмешательство не привело к другим мутациям. Отдельно они подтвердили эффективность своей системы на выращенных из стволовых клеток культурах мышечных клеток человека, несущих ту же мутацию в 52-м экзоне DMD.
Опыты по исправлению мутаций, приводящих к миодистрофии Дюшенна, проводились и раньше. Новизна нынешнего исследования в том, что его авторы показали положительный результат на свиньях, а не на мышах. Из-за своего размера свиньи лучше подходят для моделирования человеческих заболеваний и экспериментальных методов лечения. Особо стоит отметить успешное редактирование геномов кардиомиоцитов, так как большая часть этих клеток активна на протяжении всей жизни организма, а значит, их исправление приводит к пожизненному улучшению сердечной деятельности.
Источник
A. Moretti, et al. // Somatic gene editing ameliorates skeletal and cardiac muscle failure in pig and human models of Duchenne muscular dystrophy // Nature Medicine, 2020; DOI: 10.1038/s41591-019-0738-2


 Меню
Меню





 Все темы
Все темы




 0
0








