GPR141 увеличивает агрессивность рака молочной железы
Ученые из Индии исследовали роль белка GPR141 в развитии рака молочной железы. Эксперименты на клеточных культурах и мышиных моделях показали, что GPR141 регулирует онкогенез посредством модуляции p-mTOR1/p53 сигналинга, и оверэкспрессия этого белка повышает агрессивность опухоли.
Один из ключевых показателей агрессивности опухолей — это способность раковых клеток к метастазированию. Важную роль в этих процессах играют мембранные белки GPCR (G-protein-coupled receptor). Авторы данной статьи исследовали влияние GPR141 (GPCR 141) на биологию опухолевых клеток рака молочной железы (РМЖ).
Первым шагом авторы сравнили экспрессию GPR141 в здоровых клетках молочной железы и РМЖ. Увеличенная экспрессия GPR141 наблюдалась в различных подтипах РМЖ, чаще всего в инвазивной смешанной муцинозной карциноме и инвазивной протоковой карциноме молочной железы. Искусственное увеличение экспрессии GPR141 в двух клеточных линиях РМЖ привело к появлению признаков эпителиально-мезенхимального перехода: у клеток возросла экспрессия мезенхимальных белков (Snail и N-кадгерин) и снизилось количество эпителиального маркера Е-кадгерина. Также увеличилась экспрессия фактора VEGF, стимулирующего неоангиогенез, и MMP7, участвующего в деградации E-кадгерина и, как следствие, в метастазировании. Кроме того, при оверэкспрессии GPR141 в клеточных линиях РМЖ наблюдалось повышение уровня онкогенных факторов фибронектина, HIF1α и c-Myc. Наконец, миграционная активность таких клеток была увеличена по сравнению с нормальными клетками молочной железы.
Затем авторы установили, что GPR141 модулирует экспрессию p53. Интересно, что при оверэкспрессии GPR141 уровень p53 понижен независимо от транскрипции. Исследователи предположили, что причиной этого может быть повышенная деградация p53. Анализ данных TCGA (атлас ракового генома) для 1084 образцов инвазивной карциномы молочной железы также выявил отрицательную корреляцию между экспрессией p53 и GPR141 на уровне мРНК. Чтобы установить механизм снижения экспрессии p53, авторы изучили особенности его деградации в клетке. Когда клетки РМЖ, оверэкспрессирующие GPR141, обрабатывали ингибитором протеасом, уровень p53 в них возрастал. Один из важных клеточных механизмов в данном случае — это убиквитинзависимая протеасомная деградация. Авторы показали, что E3-убиквитинлигаза Cullin1 связывается с p53 как в контрольных клетках РМЖ, так и при оверэкспрессии GPR141. Очевидно, это один из механизмов, с помощью которых GPR141 снижает экспрессию р53.
Кроме того, экспрессия GPR141 связана с регуляцией клеточного цикла. Высокий уровень циклинов D1 и D3 в клеточных линиях РМЖ указывает на активную пролиферацию. Также авторы установили, что экспрессия CDK4, p21 и p27 зависит от GPR141 и снижается при его оверэкспрессии, а количество формируемых колоний и скорость пролиферации при этом возрастают. Анализ клеточного цикла с помощью FACS показал усиленный переход от G1 к S фазе по сравнению с контрольными клетками РМЖ.
Далее ученые измерили уровни фосфорилирования киназ в клеточных линиях РМЖ, чтобы выявить различные сигнальные пути, опосредующие GPR141-зависимый онкогенез. Оверэкспрессия GPR141 усилила фосфорилирование mTOR1 в клетках. Геномный анализ образцов инвазивного РМЖ из базы данных TCGA выявил положительную корреляцию между экспрессией мРНК mTOR и GPR141.Следующим шагом авторы изучили роль GPR141 в сигнальном пути p-mTOR1/p53. Для этого на клетки с оверэкпрессированным GPR141 и контрольные клетки подействовали ингибитором mTOR — рапамицином. Это снижало их способность образовывать колонии, пролиферировать и мигрировать. Кроме того, в таких клетках уменьшалось количество активных форм кислорода, которые стимулируют прогрессирование рака через многочисленные сигнальные пути, такие как mTOR, PTEN и MMP. Была также обнаружена сильная положительная корреляция между уровнем Cullin1 и mTOR, за счет чего ингибирование mTOR рапамицином восстанавливало уровень p53 в клетках с оверэкпрессированным GPR141.
Для лучшего понимания роли GPR141 в прогрессии РМЖ авторы ингибировали его экспрессию с помощью РНК-интерференции. Это увеличивало экспрессию p53 и эпителиального маркера Е-кадгерина на протеомном и траскриптомном уровнях, а также снижало фосфорилирование субстратов mTOR1. Нокдаун GPR141 сдерживал клеточную пролиферацию и миграцию и приводил к остановке клеточного цикла в фазе G1.
Наконец, авторы подтвердили свои наблюдения на мышах. Животным вводили клетки РМЖ с нормальной и с повышенной экспрессией GPR141. В последнем случае опухоли росли активнее, чем при нормальном уровне GPR141. На модели куриной хориоаллантоидной мембраны также продемонстрировали, что оверэкспрессия GPR141 способствует развитию опухоли. Иммуногистохимия показала увеличение количества Ki67, N-кадгерина и p-mTOR1 в тех опухолях, которые были сформированы из оверэкспрессирующих GPR141 клеток. В мышином ксенотрансплантанте также возросла экспрессия Snail и снизилось количество E-кадгерина при повышенном уровне GPR141.
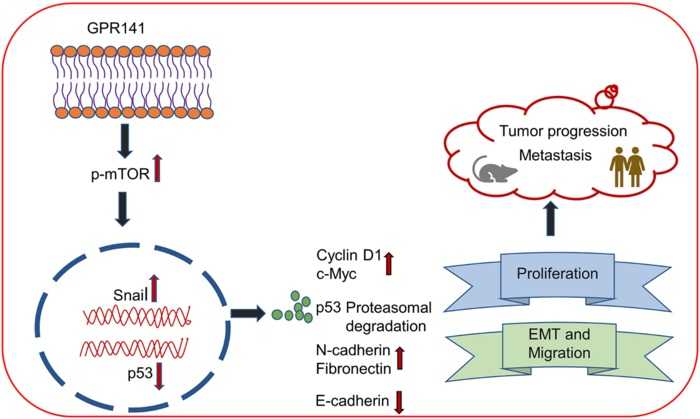 Механизм, связывающий GPR141 с прогрессией опухоли. E3-убиквитинлигаза Cullin1 частично опосредует деградацию р53 через протеасомный путь. При оверэкспрессии GPR141 Cullin1 взаимодействует с p-mTOR1— это усиливает деградацию p53, тем самым вызывая рост опухоли. Нокдаун GPR141 восстанавливает экспрессию p53 и ослабляет активность p-mTOR1, тем самым препятствуя пролиферации и миграции клеток рака молочной железы.
Механизм, связывающий GPR141 с прогрессией опухоли. E3-убиквитинлигаза Cullin1 частично опосредует деградацию р53 через протеасомный путь. При оверэкспрессии GPR141 Cullin1 взаимодействует с p-mTOR1— это усиливает деградацию p53, тем самым вызывая рост опухоли. Нокдаун GPR141 восстанавливает экспрессию p53 и ослабляет активность p-mTOR1, тем самым препятствуя пролиферации и миграции клеток рака молочной железы.Credit: 2023 Parija et al.
Таким образом, данная работа раскрывает молекулярный механизм, обуславливающий снижение уровня экспрессии р53 и активацию p-mTOR1 и его субстратов при оверэкспрессии GPR141 в клетках РМЖ. Модулирование экспрессии GPR141 может проложить путь для лучшего терапевтического подхода к регулированию прогрессии и метастазирования рака молочной железы.
Белок TMEM165 контролирует переход рака молочной железы в более опасную форму


 Меню
Меню





 Все темы
Все темы




 0
0








