ИИ детектирует рак по изменениям хроматина в клетках крови
Группа ученых из Швейцарии разработала алгоритм машинного обучения, способный детектировать рак по изображениям хроматина мононуклеарных клеток. Алгоритм показал точность до 89% при определении типа рака у 30 пациентов, проходящих протонную терапию. Результаты опубликованы в npj Precision Oncology.
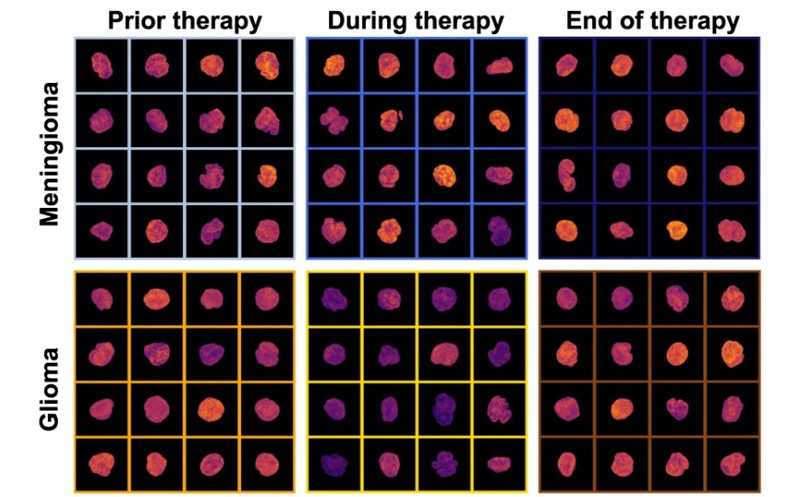
Мононуклеарные клетки пациентов с менингиомой и глиомой, полученные до, во время и по окончании протонной терапии.
Credit:
npj Precision Oncology (2023). DOI:
10.1038/s41698-023-00484-8 |
CC BY
Раковые клетки выделяют в опухолевое микроокружение различные секретируемые факторы, которые отвечают за поддержание роста и прогрессии опухоли. Так как в опухоли есть кровеносные сосуды, эти факторы попадают в системный кровоток. Состав опухолевого секретома варьируется в зависимости от стадии заболевания.
Опухолевые секретируемые факторы могут оказывать влияние на клетки крови, в частности, на мононуклеарные клетки. К последним относятся клетки лимфатического ряда (Т- и B-лимфоциты и NK-клетки), моноциты и дендритные клетки. Группа швейцарских исследователей разработала алгоритм искусственного интеллекта для анализа пространственной организации хроматина в мононуклеарных клетках, полученных от пациентов, проходящих протонную терапию.
Алгоритм использовал изображения флуоресцентной микроскопии единичных клеток, полученные из жидкостных биопсий у 10 здоровых людей, 10 пациентов с разнообразными типами опухолей (пан-раковая выборка) и 30 пациентов с тремя типами рака — менингиомой, глиомой и опухолями головы и шеи — проходящих протонную терапию. Терапия приводит к снижению концентрации опухолевых факторов в крови, что отражается на организации хроматина мононуклеарных клеток. Для анализа происходящих изменений клетки окрашивали на маркер повреждения ДНК (ɣH2AX), ядерный структурный белок (ламин A/C) и поверхностные маркеры (CD3, CD4 и CD8), а также применяли DAPI для окраски хроматина.
Авторы обнаружили, что организация хроматина мононуклеарных клеток сильно различается у здоровых людей и у пациентов с раком. При раке часто наблюдалась фрагментация ядер мононуклеарных клеток. Между типами опухолей также имелись различия в объеме ядер, содержании гетерохроматина и морфологии ядерной мембраны.
ИИ-модель показала способность отличать мононуклеарные клетки разных типов рака. Средняя точность классификации составила 78%. С 89% точностью модель определяла мононуклеарные клетки пациентов с опухолями головы и шеи. Однако модель часто путала мононуклеарные клетки пациентов с менингиомой и глиомой, показывая точность классификации на уровне 75% и 69% соответственно. Это предполагает схожий профиль хроматина у двух этих опухолей мозга.
Далее авторы проверили, влияет ли протонная терапия на состояние хроматина мононуклеарных клеток. В эту часть исследования включили 10 пациентов с менингиомой, 10 — с глиомой и 10 — с опухолями головы и шеи. Жидкостные биопсии брали в трех временных точках: до начала, во время и в конце терапии. Оказалось, что организация хроматина изменяется в зависимости от этапа протонной терапии, и модель способна различать эти этапы. Точность классификации составила 82% для менингиомы, 83% для глиомы и 64% для опухолей головы и шеи. Исследователи обнаружили, что к концу протонной терапии в мононуклеарных клетках восстанавливается экспрессия ядерных ламинов и снижается экспрессия маркеров повреждения ДНК. Также в ходе протонной терапии уменьшалась популяция CD4+ клеток, тогда как популяция CD8+ клеток, наоборот, увеличивалась.
Разработанная ИИ-модель для идентификации изменений состояния хроматина в мононуклеарных клетках может применяться в диагностике рака и в оценке ответа пациента на терапию.
Источник
Challa, K., et al. Imaging and AI based chromatin biomarkers for diagnosis and therapy evaluation from liquid biopsies // npj Precis. Onc. 2023. DOI: 10.1038/s41698-023-00484-8


 Меню
Меню





 Все темы
Все темы




 0
0








