Иммуноглобулины A в комплексе с антигенами вируса запускают нетоз
Канадские ученые показали, что одним из механизмов ответа на вирусную инфекцию служит запуск IgA-опосредованного нетоза — реакции на внешний стимул, при которой клетка выбрасывает ДНК. Иммунный комплекс IgA с вирусным антигеном связывается с рецептором FcαRI на поверхности нейтрофила, что приводит к выбросу внеклеточных ловушек.
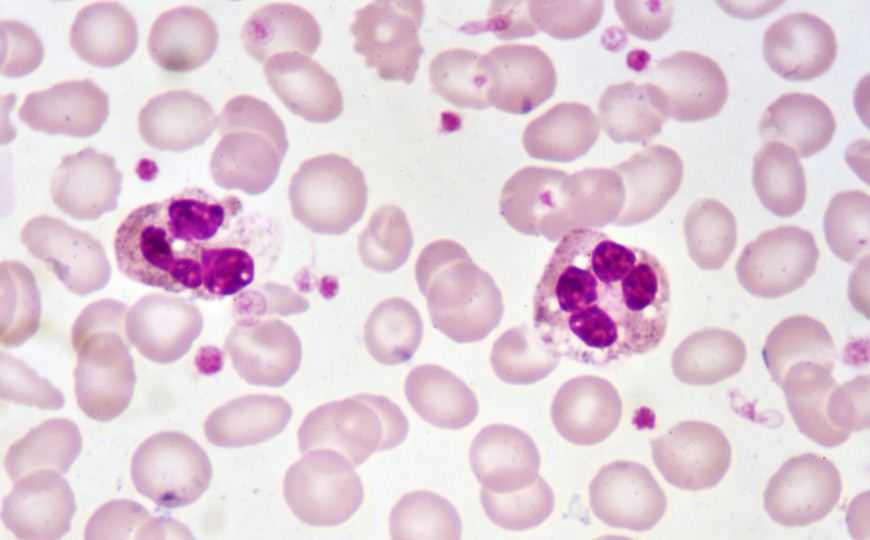
Иммуноглобулиины A (IgA) — это класс антител, обильных в кровотоке и на поверхности слизистых оболочек. Группа ученых под руководством Мэтью Миллера, доцента Института инфекционных заболеваний Макмастерского университета, изучила роль IgA в нетозе — образовании нейтрофильных внеклеточных ловушек.
Нетоз происходит при взаимодействии с патогенами, антителами и иммунными комплексами. Нейтрофилы выбрасывают внеклеточные ловушки, представляющие собой деконденсированный хроматин и белки, обладающие бактерицидными свойствами. гранулы.
Авторы новой работы показали на культурах нейтрофилов, что IgA из периферической крови от привитых от гриппа доноров, связанные с антигеном вируса гриппа А, запускают нетоз. При этом антиген вируса гриппа A или IgA по отдельности не дают такого эффекта.
Известно, однако, что некоторые вирусные антигены способны самостоятельно вызывать нетоз. В следующей серии экспериментов исследователи работали с S-белком SARS-CoV-2. Концентрация этого антигена, необходимая для запуска нетоза, варьировала от 0,05 до 0,2 мг/мл. При добавлении IgA, выделенных из сыворотки пациентов с COVID-19, пороговая концентрация S-белка снизилась до 0,0125 мг/мл. Похожие эксперименты с сопоставимым результатом были проведены с антигеном ВИЧ и аутоантигеном, характерным для ревматоидного артрита. Это означает, что образование иммунных комплексов IgA-антиген усиливает нетоз.
В организме человека IgA могут присутствовать как в мономерной, так и в димерной формах. В образовании димерной формы принимают участие Fc-фрагменты молекулы. Эксперименты, описанные выше, проводили с использованием мономерных IgA. Димеры IgA, выделенные из слюны доноров, не запускали нетоз. Ученые предположили, что IgA стимулируют нетоз, взаимодействуя с рецептором фрагмента Fc — FcαRI (СD89) — на поверхности нейтрофилов. В димерах же фрагмент Fc занят и не может связаться с FcαRI. Предположение подтвердилсь в опытах с различными формами IgA. При этом фагоцитоз и сигнализация от TLR, необходимые для запуска нетоза другими активаторами, в данном случае были не нужны.
Различают два вида нетоза: суицидальный (связан с синтезом активных форм кислорода, приводит к гибели нейтрофила) и витальный (не требует образования АФК, не приводит к гибели нейрофила). В образовании АФК участвует НАДФH-оксидазный комплекс. Кроме того, суицидальный нетоз отличается от витального временем развития. В опытах с ингибитором НАДФH-оксидазного комплекса ученые показали, что IgA-опосредованный нетоз является АФК-зависимым и развивается в течение трех часов. Это указывает на суицидальный механизм.
Наконец, в экспериментах с флуоресцентно-мечеными частицами вируса гриппа A и стимулированными нейтрофилами было показано, что нетоз приводит к инактивации вируса. Заразность вирусных частиц, побывавших во внеклеточных ловушках нейтрофилов, сильно снижалась.
Результаты исследования говорят о важной роли антител IgA на начальных этапах вирусной инфекции. По мнению авторов, исследование полезно для разработки вакцин в виде аэрозоля или назального спрея, стимулирующих иммунный ответ слизистых.
«Вакцины могут индуцировать антитела IgA в легких — антитела, которые первыми встречаются с вирусами гриппа или COVID-19, инфицирующие легкие и респираторный тракт, — говорит Мэтью Миллер. — Механизмы, которые могут остановить инфекцию в месте ее проникновения, предотвратят распространение заболевания и серьезные осложнения».
Источник
H. D. Stacey, et al. // IgA potentiates NETosis in response to viral infection. // Proceedings of the National Academy of Sciences (2021); DOI: 10.1073/pnas.2101497118
Цитата по пресс-релизу


 Меню
Меню





 Все темы
Все темы




 0
0








