Иммунотерапия подавляет метастазирование опухоли, уничтожая лимфатические сосуды
При иммунотерапии цитотоксические T-клетки не только атакуют опухоль, но и уничтожают ее лимфатические сосуды, что снижает вероятность метастазирования. Исследователи из Швейцарии выявили механизм этого процесса. T-клетки выделяют интерферон-γ, который позволяет лимфатическим эндотелиальным клеткам презентировать опухолевые антигены, что приводит к их апоптозу.
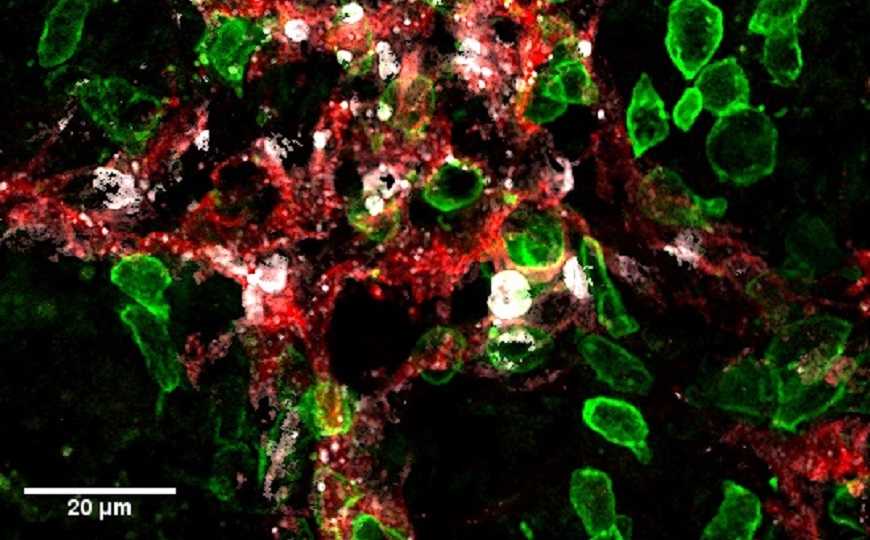
T-клетки (зеленые) атакуют лимфатические сосуды (красные) в опухоли и индуцируют апоптоз (белый).
Credit:
UNIGE - Robert Pick / Stéphanie Hugues | Пресс-релиз
Раковые клетки могут распространяться как через кровеносные сосуды, так и через периферическую лимфатическую систему. Исследования на мышах и людях показывают, что лимфатические эндотелиальные клетки (lymphatic endothelial cells, LEC) реагируют на факторы, присутствующие в микроокружении опухоли, что способствует росту и ремоделированию лимфатических сосудов в первичных опухолях. Этот процесс называется лимфангиогенезом и коррелирует с метастазированием и снижением безрецидивной выживаемости.
Ученые из Швейцарии исследовали взаимодействие Т-клеток с LEC. Они получили мышей с опухолями из клеток меланомы 16F10-OVA+VC+, которые экспрессируют модельный антиген OVA и вырабатывают повышенное количество лимфангиогенного фактора VEGF-C. Авторы подсадили этим мышам Т-клетки, таргетирующие OVA. Пересадка Т-клеток приводила к регрессии опухоли, значительному снижению плотности опухолевых LEC, а также к повышению в них экспрессии проапоптотического маркера — активированной каспазы 3. В то же время ученые не наблюдали какого-либо воздействия Т-клеток на пролиферацию LEC.
В другом эксперименте авторы показали, что для запуска апоптоза в LEC требуется повышенная концентрация Т-клеток в опухоли. В частности, снижение роста опухоли коррелирует с плотностью Т-клеток, продуцирующих IFN-γ и гранзим-В. От дозы Т-клеток зависели также частота апоптоза и плотность LEC. Ученые предполагают, что повышенная плотность Т-клеток необходима, чтобы обойти иммуносупрессивное влияние лимфатического IFN-γ путем уничтожения LEC.
Исследователи обнаружили, что введение Т-лимфоцитов предотвращает метастазирование опухоли по лимфатической системе. Они наблюдали увеличение доли подмышечных и плечевых лимфатических узлов без метастазов. Ученые также доказали, что снижение метастазирующей активности связано не с уменьшением размера первичной опухоли, а с апоптозом LEC и разрушением опухолевых лимфатических сосудов.
Известно, что IFN-γ также связан с разрушением лимфатических сосудов. Поскольку эффекторные Т-клетки представляют собой существенный источник IFN-γ в опухолях, ученые попытались найти взаимосвязь между его сигнальным каскадом и разрушением лимфатических сосудов. Они обнаружили, что IFN-γ активирует синтез MHCI, PD-L1 и других генов ответа на IFN-γ. В контрольных LEC с нокаутом рецептора IFN-γ таких результатов не наблюдалось. Более того, в нокаутной модели возросла метастазирующая активность опухоли.
Эффекторные Т-клетки индуцировали апоптоз in vitro исключительно в LEC дикого типа с пептидом OVA. В то же время антитела, блокирующие IFN-γ, не предотвращали апоптоз LEC, демонстрируя, что IFN-γ не оказывает прямого проапоптотического эффекта. Тем не менее IFN-γ влиял на другое свойство LEC: ученые показали, что под воздействием IFN-γ LEC приобретают возможность презентировать опухолевые антигены. Апоптоз, опосредованный вмешательством Т-клеток, был активирован благодаря презентированию антигена OVA в комплексе с MHCI.
Таким образом, ученые продемонстрировали способность Т-клеток препятствовать метастазированию опухоли. Это происходит благодаря активации апоптоза в эпителиальных клетках лимфатических сосудов. Под воздействием Т-клеточного IFN-γ эпителиальные клетки приобретают способность к презентированию опухолевых антигенов, что способствует активации иммунного ответа.
Источник
Laure Garnier, et al. IFN-γ–dependent tumor-antigen cross-presentation by lymphatic endothelial cells promotes their killing by T cells and inhibits metastasis. // Science Advances. 2022. DOI: 10.1126/sciadv.abl5162


 Меню
Меню





 Все темы
Все темы




 0
0








