Индивидуальные опухолевые органоиды предсказывают реакцию пациентов на терапию рака мозга
Ученые из Китая и Германии разработали метод создания индивидуальных опухолевых органоидов пациента (IPTO), моделирующих рак мозга и метастазы. Эти органоиды, полученные из тканей пациентов, воспроизводят структуру и микроокружение опухоли, включая кровеносные сосуды, нейральные маркеры, маркеры пролиферации и пространственную гетерогенность, а также отражают ответ пациентов на терапию. У пациентов, IPTO которых были чувствительны к темозоломиду, при лечении этим препаратом выживаемость без прогрессирования и общая выживаемость оказались более продолжительными
Органоиды, полученные из опухолей пациентов (patient tumor organoids, PTO), представляют собой мини-опухоли, выращенные in vitro из хирургического материала, и широко используются в исследованиях рака. Благодаря схожести с реальными опухолями, они являются перспективным инструментом для доклинических испытаний, особенно при изучении глиобластомы — одной из самых агрессивных опухолей мозга. PTO позволяют оценивать индивидуальную реакцию на терапию, что имеет важное значение для персонализированной онкологии.
Однако воспроизведение сложного клеточного состава и микроокружения опухоли остается серьезной проблемой. Многие существующие модели теряют ключевые свойства или не передают взаимодействие клеток в достаточной степени, что снижает точность прогнозирования реакции пациентов на лекарства. Это объясняет, почему некоторые препараты, эффективные в лабораторных условиях, не дают ожидаемых результатов в клинических испытаниях. Для повышения надежности доклинических исследований необходимы более совершенные модели, способные точно передавать характеристики опухолей мозга и предсказывать индивидуальный ответ на лечение.
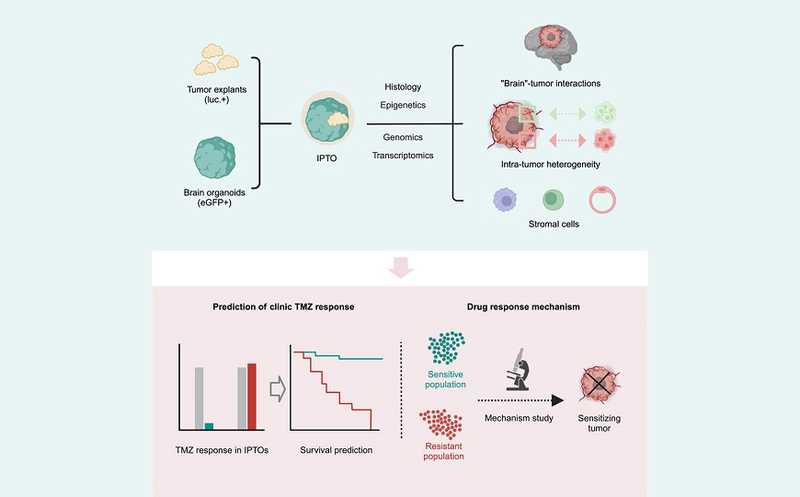
Для решения этой проблемы исследователи из Китая и Германии разработали индивидуальные опухолевые органоиды пациента (IPTO), используя церебральные органоиды — миниатюрные модели мозга, выращенные в лаборатории из индуцированных плюрипотентных стволовых клеток. В эти структуры помещали небольшие фрагменты опухолевой ткани, что позволяло сохранить клеточную архитектуру, микроокружение и молекулярные особенности опухоли. Метод IPTO применим к широкому спектру опухолей центральной нервной системы, включая глиобластомы, астроцитомы, педиатрические опухоли, такие как пилоцитарная астроцитома, эпендимома, медуллобластома и глиобластома с мутацией гистона 3.3, а также метастатические опухоли мозга, происходящие из меланомы, рака легких, толстой кишки и молочной железы.
Гистологический анализ подтвердил, что IPTO воспроизводят структуру опухоли, включая кровеносные сосуды, нейральные маркеры и маркеры пролиферации, а также пространственную гетерогенность. Полноэкзомное секвенирование и анализ метилирования ДНК продемонстрировали, что IPTO обладают тем же спектром соматических мутаций, вариаций числа копий и эпигенетических изменений, что и исходные опухоли. Анализ транскриптома единичных клеток выявил сохранность клеточной гетерогенности, включая разнообразие опухолевых, стромальных и иммунных клеток, что подтверждает близкое соответствие IPTO и первичной опухоли.
Одним из ключевых достижений стало подтверждение, что IPTO способны предсказывать реакцию пациентов на лечение. В проспективном клиническом исследовании IPTO от 35 пациентов обрабатывали темозоломидом (TMZ), стандартным препаратом для лечения глиобластомы. Была показана высокая корреляция между чувствительностью IPTO и клиническим ответом пациентов. Пациенты с чувствительными к TMZ IPTO при лечении этим препаратом имели более длительные выживаемость без прогрессирования и общую выживаемость, в то время как пациенты с резистентными IPTO показали худшие клинические исходы.
Модель IPTO также позволила исследовать механизмы устойчивости опухолей к терапии. Секвенирование РНК единичных клеток в IPTO, обработанных TMZ, выявило, что опухолевые клетки, подобные клеткам-предшественникам нейронов, были чувствительны к препарату, тогда как подобные астроцитам и мезенхимальным клеткам проявляли устойчивость. Авторы определили специфические сигнальные пути и гены, связанные с резистентностью к TMZ. В частности, они наблюдали увеличение доли опухолевых стволовых клеток, устойчивых к терапии.
Помимо TMZ, IPTO могут применяться для тестирования эффективности других противоопухолевых препаратов. Например, модель использовалась для оценки действия осимертиниба, ингибитора EGFR, при метастазах рака легких в головной мозг.
IPTO создаются в течение 10 дней после операции и могут использоваться для изучения механизмов лекарственной резистентности. Анализ единичных клеток в этих моделях помогает выявлять сигнальные пути, ответственные за устойчивость к терапии, что важно для разработки новых методов лечения. В целом, разработка IPTO открывает новые возможности для персонализированной онкологии, приближая медицину к созданию терапевтических подходов, адаптированных к индивидуальным особенностям каждого пациента.
Соединенные аксонами органоиды мозга обладают кратковременной пластичностью
Источник:
Peng T., et al. Individualized patient tumor organoids faithfully preserve human brain tumor ecosystems and predict patient response to therapy. // Cell Stem Cell 32, 1-18 (2025), published online 11 February 2025. DOI: 10.1016/j.stem.2025.01.002


 Меню
Меню





 Все темы
Все темы



 0
0