Химерный белок ACE2-Fc эффективно нейтрализует новые варианты SARS-CoV-2
Ученые из Германии создали химерные белки, состоящие из эктодомена рецептора АСЕ2 и Fс-домена IgG. Такие конструкции успешно нейтрализовали SARS-CoV-1 и SARS-CoV-2 in vitro. В отличие от антител к SARS-CoV-2, химерные конструкции более эффективно связываются с новыми вариантами коронавируса, чем с вирусом дикого типа.
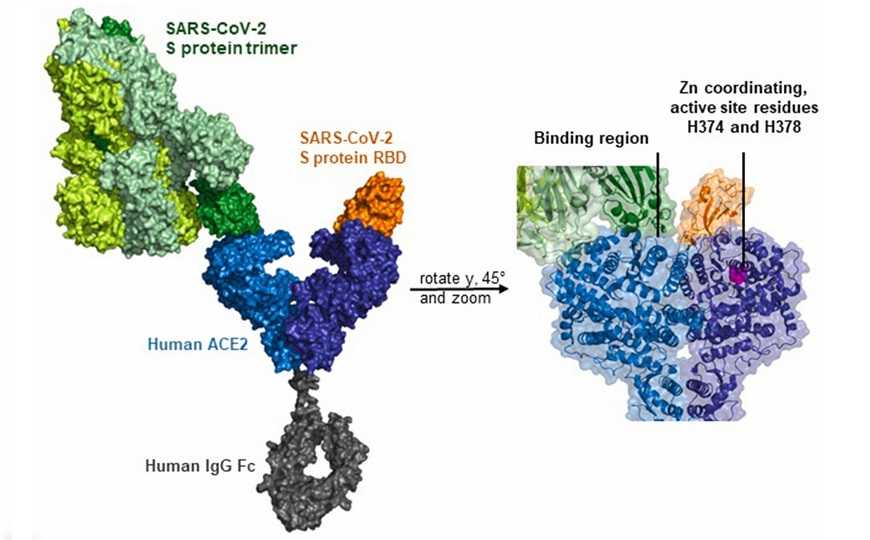
Модель химерного белка ACE2-Fc, взаимодействующего с S-белком коронавируса | Svilenov H., et al. DOI: 10.1016/j.antiviral.2021.105197
Ангиотензин превращающий фермент (АСЕ2) — это молекула, являющаяся основной «дверью» вируса SARS-CoV-2 в клетку хозяина. Увеличение скорости распространения новых штаммов вируса тесно связано с усилением сродства вирусного поверхностного гликопротеина (S-белка) к эктодомену АСЕ2. Ранее было показано, что растворимый АСЕ2 способен ингибировать размножение SARS-CoV-2 в клетках. Этот белок был получен в рекомбинантном виде, и в настоящее время австрийская компания APEIRON Biologics проводит его клинические испытания в качестве терапевтического антивирусного препарата под названием APNO1. Однако возможности использования такого препарата ограничены быстрой деградацией этого белка. Более стабильным представляется вариант, когда эктодомен АСЕ2 включен в состав белка-химеры. Таким вариантом может быть слияние с константным доменом (Fc) молекулы IgG. Однако опасения вызывает способность Fc связываться со специфичными рецепторами и вызывать нежелательные явления, такие как цитотоксичность. Проблему может решить выбор другого подтипа IgG для конструкции химеры, поскольку домены разных подтипов связываются с Fc-рецепторами с разной аффинностью.
В новом исследовании авторы сконструировали несколько разных химерных белков, используя Fc-домен IgG первого и четвертого подтипа, и проверили их нейтрализующие способности.
С помощью программы PyMol, которая позволяет визуализировать молекулы, авторы сгенерировали восемь моделей химерного белка АСЕ2-Fс с разными биологическими свойствами. Использовали последовательности IgG1 или IgG4 с заменой S228P и АСЕ2 с эктодоменом разной длины и c мутациями, в том числе элиминирующими энзиматическую активность. После этого белки экспрессировали в бактериальных клетках и очищали хроматографическими методами. Ученые показали, что полученные белки образуют гомодимеры благодаря дисульфидным связям.
Параметры связывания ACE2-Fc c рекомбинантным иммобилизованным рецептор-связывающим доменом (RBD) S-белка SARS-CoV-2 определяли с помощью плазмонного резонанса. В качестве контроля использовали афлиберцепт — химерный белок, состоящий из Fc-домена IgG1 и части васкулярного эндотелиального фактора роста. Сила связывания различных вариантов ACE2-Fc с RBD была пропорциональна концентрации.
Тем же методом исследовали связывание четырех химерных конструктов, содержащих Fc-домены IgG1 или IgG4, с Fc-рецепторами. Оказалось, что конструкты ACE2-IgG4-Fc несколько слабее, чем ACE2-IgG1-Fc, взаимодействуют с рецепторами FcγRI и совсем не связываются с FcγRIIIа. Все конструкты с высокой аффинностью связывались с рецептором FcRn. С этим взаимодействием связано время жизни IgG, поэтому важно, что этот показатель оказался примерно одинаковым у химер с Fc-доменами IgG1 и IgG4.
Нейтрализующий эффект химерных белков протестировали методом ELISA. В этой реакции смотрели, как химерные белки ингибируют связывание S1-субъединицы S-белка SARS-CoV-2 с рецепторами ACE1. Все конструкты продемонстрировали хорошую нейтрализующую активность.
Способность двух химерных конструктов на базе IgG4 нейтрализовать живой вирус испытали в клетках Vero E6. Клетки инкубировали с химерными белками в различных разведениях и затем инфицировали меченым GFP вирусом SARS-CoV-2. По флуоресценции наблюдали за развитием вирусной инфекции. Оба конструкта эффективно ингибировали размножение вируса.
Затем все восемь конструкций проверили на панели вирусных изолятов, полученных от пациентов с SARS-CoV-1 (в 2003 году) и SARS-CoV-2. В последнем случае это были вирусы двух разных штаммов с заменой D614G в S-белке. Все конструкты успешно нейтрализовали SARS-CoV-1, хотя и в более высоких концентрациях, чем новый коронавирус. При этом из двух штаммов SARS-CoV-2 значительно эффективнее нейтрализовался более поздний вариант. Еще лучше конструкты ACE2-IgG4-Fc ингибировали варианты альфа, бета и дельта. IС50 в этих случаях достигала порядка пикамолей. По мнению авторов, такие результаты говорят о том, что химерные конструкты на базе IgG4 обладают способностью усиливать нейтрализующий эффект по мере увеличения адаптации коронавируса.
Источник
Svilenov H., et al. Picomolar inhibition of SARS-CoV-2 variants of concern by an engineered ACE2-IgG4-Fc fusion protein // Antiviral Research, Volume 196, December 2021, 105197; DOI: 10.1016/j.antiviral.2021.105197


 Меню
Меню





 Все темы
Все темы




 0
0








