Киназы регулируют конденсацию комплексов SMN в ядре
Активность комплекса SMN, который управляет сплайсингом, коррелирует с его конденсацией в тельца Кахаля в ядре. Ученые из Германии выявили, что конденсация, в свою очередь, зависит от фосфорилирования компонентов комплекса киназами RPS6KB1 и mTOR. Этот результат может найти применение в терапии спинальной мышечной атрофии, которую вызывают мутации в гене белка SMN.
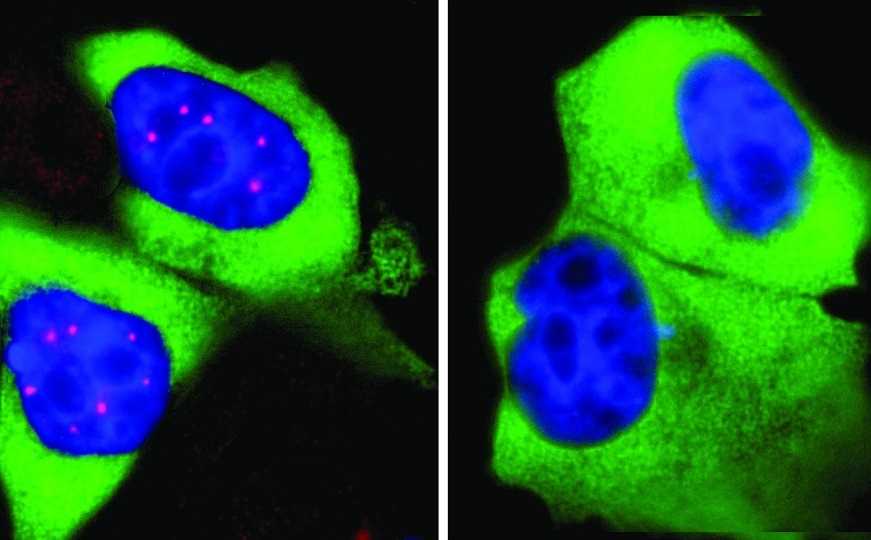
SMN сконцентрирован в тельцах Кахаля (красный цвет) в ядре клеток человека (синий). Если фосфорилирование SMN ингибируется, концентрация прекращается и тельца Кахаля исчезают.
Credit:
AG Gruss | Боннский университет | Пресс-релиз
Считывание генетической информации в ядре клетки регулируется на нескольких уровнях. Вначале в ядре синтезируется транскрипт, который подвергается сплайсингу —вырезанию некодирующих участков, или интронов. Важную роль в данном процессе играет комплекс SMN; в его состав входит белок SMN (survival motor neuron), мутации в гене которого могут быть причиной спинальной мышечной атрофии, а также другие белки.
Комплекс SMN осуществляет сборку сплайсосомы в цитоплазме и затем мигрирует вместе с ней в ядро, где встраивается в тельца Кахаля — специфические структуры, в которых осуществляется процессинг мРНК. В активно пролиферирующих клетках и клетках с высокой синтетической активностью комплексы SMN агрегируют друг с другом в ядре, за счет чего повышается их активность. Менханизмы агрегации до сих пор не были детально изучены. Группа ученых из Германии обнаружила, что конденсация комплексов SMN в тельцах Кахаля коррелирует с их фосфорилированием, которое осуществляют специальные ферменты — киназы.
Авторы выдвинули предположение о роли фосфорилирования, поскольку было известно, что SMN комплексы содержат высокое количество фосфатных групп, в связи с чем. В человеческих клетках, выращиваемых in vitro, они провели нокдаун нескольких киназ. Наибольший эффект показала инактивация рибосомной протеинкиназы S6 бета-1 (RPS6KB1). После ее нокаута доля клеток с конденсатами SMN комплексов в ядре снизилась на 92%. Активность RPS6KB1 зависит от другой известной киназы — mTOR. Вместе они регулируют пролиферацию, выживаемость клеток, а также участвуют в ответе на стресс.
В ходе последующих экспериментов авторы установили, что в отсутствии данных киназ степень фосфорилирования SMN комплексов значительно снижается, и это приводит к дезинтеграции телец Кахаля. Это открытие особенно значимо, так как RPS6KB1 и mTOR регулируют не только сплайсинг, но и трансляцию мРНК, образовавшихся в результате сплайсинга.
Новые результаты важны и с точки зрения генетический причин спинальной мышечной атрофии (СМА). «Некоторые дефекты в генах, которые приводят к спинальной мышечной атрофии, располагаются возле сайтов фосфорилирования комплекса SMN», — объясняет профессор Оливер Грусс из Института генетики Боннского университета. Как предполагают авторы, у больных СМА может быть нарушено фосфорилирование по данным сайтам и, следовательно, образование телец Кахаля, что приводит к дефектам сплайсинга.
Эксперименты на мышиных фибробластах, моделирующих СМА, показали, что агенты, которые увеличивают активности этих киназ, также способствуют конденсации SMN комплексов в тельца Кахаля. По мнению авторов, этот эффект потенциально может быть использован в терапии СМА.
Источник
Schilling et al. // TOR signaling regulates liquid phase separation of the SMN complex governing snRNP biogenesis // Cell Reports 35, 109277, published June 22, 2021. DOI: 10.1016/j. celrep.2021.109277
Цитата по пресс-релизу


 Меню
Меню





 Все темы
Все темы




 0
0








