Комбинация иммунотерапии и ингибиторов KRAS помогает при раке поджелудочной железы с мутацией KRAS
Мутированный протоонкоген KRAS блокирует экспрессию рецептора смерти Fas, что позволяет раковым клеткам уходить от иммунного ответа. Эффективность монотерапии ингибиторами KRASG12D зависит от активности CD8+ Т-лимфоцитов. Использование ингибиторов KRASG12D вместе с ингибиторами контрольных точек иммунного ответа вызывает регрессию опухоли и улучшает показатели выживаемости.
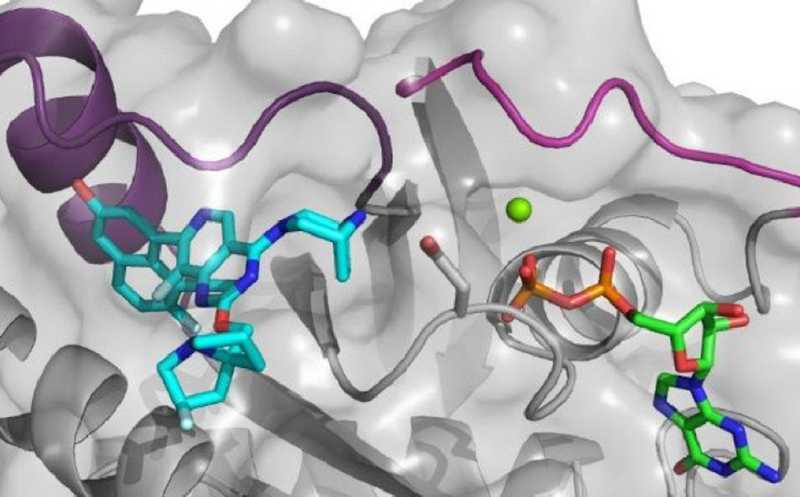
Ингибитор MRTX1133 (бирюзовый) взаимодействует с KRASG12D и гуанозиндифосфатом
Credit:
J. Med. Chem. December 10, 2021, DOI: 10.1021/acs.jmedchem.1c01688 | CC-BY 4.0
Мутация протоонкогена KRASG12D присутствует примерно в половине аденокарцином поджелудочной железы. Опухоли поджелудочной железы с высоким содержанием CD8+ Т-лимфоцитов имеют более хороший клинический прогноз. Исследователи из Онкологического центра Андерсона (Техасский университет) выяснили роль мутированного KRAS в уклонении раковых клеток от иммунной системы и показали, что использование малой молекулы MRTX1133 — ингибитора KRAS G12D — совместно с ингибиторами контрольных точек иммунного ответа улучшает выживаемость на мышиных моделях.
В статье, опубликованной в Developmental Cell, оценивается влияние мутированного KRAS на прогрессирование рака поджелудочной железы. Использование ингибиторов контрольных точек иммунного ответа при аденокарциноме поджелудочной железы не повышает выживаемость пациентов. Отсутствие эффекта от иммунотерапии объясняется иммуносупрессивным микроокружением опухоли, в развитие которого важный вклад вносит KRAS.
Для изучения влияния мутированного KRAS и мутаций в генах-супрессорах опухоли на микроокружение аденокарциномы исследователи использовали мышиные модели с мутированным KRAS и с генетическими изменениями в генах Smad4, Tgfbr2 и Trp53. Экспрессия KRAS в данных моделях регулировалась с помощью тетрациклин-индуцируемой генетической системы. Подавление KRAS активировало сигнальный путь рецептора Fas, что повышало количества CD4+ и CD8+ Т-лимфоцитов и снижало количества миелоидных клеток в опухоли, а также привлекало активированные антигенпрезентирующие клетки в опухолевое микроокружение.
Чтобы выяснить механизм влияния KRAS на экспрессию Fas, исследователи провели анализ методом иммунопреципитации метилированной ДНК. Результаты показали, что выключение KRAS уменьшает метилирование промотора Fas. РНК-секвенирование отдельных клеток позволило узнать, что ДНК-метилтрансфераза Dnmt1 снижает свою экспрессию на фоне выключения KRAS. Таким образом, можно предположить, что KRAS регулирует экспрессию Fas на эпигенетическом уровне.
Далее исследователи, основываясь на полученных данных о влиянии мутированного KRAS на ремоделирование опухолевого микроокружения, изучили эффект ингибитора KRASG12D — MRTX1133. Статья была опубликована в журнале Cancer Cell.
В работе использовалось 16 мышиных моделей рака поджелудочной железы. Модели включали в себя сингенные модели, полученные от пациентов ксенотрансплантаты, генетические модели KC (с мутацией KRAS G12D в одном из аллелей и с Cre-рекомбиназой под контролем тканеспецефичного промотора Pdx1) и KPPC (c мутацией KRASG12D в одном из аллелей, мутациями Trp53 в обоих аллелях и с Cre-рекомбиназой под контролем тканеспецефичного промотора Pdx1).
Исследование подтвердило, что ингибирование KRASG12D активирует сигнальный путь Fas, повышает количество CD8+ Т-лимфоцитов, замедляет рост опухоли на ранних стадиях и репрограммирует опухолевое микроокружение на ранних и поздних стадиях. Однако, несмотря на первоначальный успех, опухоли вновь вырастали.
Дальнейшие результаты показали, что если CD8+ Т-лимфоциты в опухоли находятся в подавленном состоянии, то опухоль прогрессирует даже при терапии MRTX1133. Исследователи использовали ингибиторы контрольных точек иммунного ответа — анти-PD-1 и анти-CTLA-4 — совместно с MRTX1133. Такая комбинированная терапия вызвала устойчивую регрессию опухоли и улучшила показатели выживаемости.
«Эти исследования показывают, что ингибирование KRAS работает, но монотерапия дает лишь временный ответ, особенно если речь идет об опухолях на поздних стадиях, — сказал один из руководитель исследования Анирбан Маитра из Онкологического центра Андерсона. — Использование иммунной системы путем сочетания ингибиторов KRAS с иммунотерапией позволило в полной мере реализовать эффект этих препаратов и обеспечить максимальную выживаемость в наших моделях». Авторы также отмечают, что данные исследования помогли выявить потенциальное клиническое применение MRTX1133. В настоящее время этот препарат проходит фазу 1 клинических исследований.
Источники
Mahadevan KK, et al. Elimination of oncogenic KRAS in genetic mouse models eradicates pancreatic cancer by inducing FAS-dependent apoptosis by CD8+ T cells. // Developmental Cell 2023. S1534-5807(23)00394-5, published online ahead of print, 2023 Aug 22. DOI: 10.1016/j.devcel.2023.07.025
Mahadevan KK, et al. KRASG12D inhibition reprograms the microenvironment of early and advanced pancreatic cancer to promote FAS-mediated killing by CD8+ T cells. // Cancer Cell 2023. S1535-6108(23)00242-8, published online ahead of print, 2023 Aug 23. DOI: 10.1016/j.ccell.2023.07.002
Цитата по пресс-релизу


 Меню
Меню





 Все темы
Все темы




 0
0







